- 首页 > 正文
肾域华章丨南方医科大学南方医院儿科孙良忠团队揭示肾消耗病关键发病机制
发表时间:2025-08-20 18:17:48
【导读】肾消耗病(Nphronophthisis,NPH),又称肾单位肾痨,是儿童终末期肾病(ESRD)最常见的遗传因素,研究表明,Hippo信号通路与肾消耗病发病密切相关。
2月24日,南方医科大学南方医院儿科孙良忠教授团队在国际学术期刊《Clinical and Translational Medicine》在线发表了题为“Kibra knockdown inhibits the aberrant Hippo pathway, suppresses renal cyst formation and ameliorates renal fibrosis in nphp1 KO mice”的原创性研究论文。在这项研究中,研究人员探究了Kibra调控Hippo信号通路在nphp1缺陷肾消耗病(NPH1)发病机制中的作用。研究发现NPH1小鼠肾脏存在Hippo信号通路异常激活,Hippo信号通路上游调控因子Kibra显著高表达。在NPH1患儿的肾脏组织,研究者也发现Kibra高表达和Hippo信号通路异常激活。在nphp1缺失的MDCK细胞系,敲低Kibra可以抑制Hippo信号通路激活,改善肌动蛋白细胞骨架重构。在NPH1小鼠模型中敲低Kibra不仅可抑制Hippo信号通路异常激活,还可显著减少肾囊肿形成、改善肾纤维化和炎症。研究揭示了Kibra-Hippo信号轴在nphp1缺失疾病发生发展的关键作用。Kibra-Hippo信号轴将有可能成为治疗肾消耗病的潜在靶标。该研究末位通讯作者是南方医科大学南方医院儿科孙良忠主任医师,第一和共同第一作者分别是其硕士研究生杨翌晨、八年制博士薛志鹤和博士后赖佳泳。

论文链接: https://onlinelibrary.wiley.com/doi/10.1002/ctm2.70245
研究背景
肾消耗病(NPH)是一种常染色体隐性遗传性慢性间质性囊肿性肾病,占儿童和青少年终末期肾病(ESRD)病例的10%~20%。目前已发现20余种致病基因,其中nphp1是最主要的致病基因,占基因确诊患者的一半以上。近年来,随着基因诊断的推广,临床确诊NPH病例逐渐增多。但由于发病机制未明,目前尚无特效治疗手段。深入阐明肾消耗病的发病机制,对于开发创新且有效的治疗策略至关重要。
Hippo通路是一个进化上高度保守的细胞内信号转导途径,参与细胞增殖、凋亡、分化,调控组织器官大小和肿瘤发生等多种生物学过程。该通路由上游调节因子、核心分子和下游效应子组成。在哺乳动物中,上游调节因子包括Kibra、NF2和FRMD6,核心成分包括MST1/2、SAV1、LATS1/2及MOB1A/B,转录调节因子YAP和TAZ则是主要的下游效应子。
Hippo信号通路失调在多种纤毛病中被发现,但其作用因疾病而异。在多囊肾病(ADPKD),Hippo信号通路被抑制,肾囊肿生长不被抑制;在肾消耗病中,Hippo信号通路则过度激活,参与囊肿的形成。先前的研究发现nphp4、nphp9/Nek8、nphp3和nphp16/Anks6缺陷均可激活Hippo信号通路。但作为NPH最主要致病基因nphp1缺陷的Hippo信号通路情况及其在发病中的作用,此前并不清楚。
研究结果
孙良忠教授团队通过CRISPR基因编辑技术成功构建了nphp1敲除(nphp1 KO)的MDCK细胞及nphp1 KO C57BL/6J小鼠模型。研究团队发现Hippo通路在nphp1 KO MDCK细胞、nphp1 KO小鼠肾组织,以及NPH1患者肾活检组织中均被激活。通过质粒载体对nphp1 KO MDCK细胞进行nphp1的再表达,成功逆转了这些细胞中Hippo通路的激活,这表明Hippo通路的激活与nphp1 KO MDCK细胞中nphp1 的缺陷有关。
进一步研究发现,nphp1 KOMDCK细胞、nphp1KO小鼠和NPH1患者肾脏显著高表达上游激活因子Kibra。通过构建siRNA和AAV载体分别在MDCK细胞和小鼠模型中敲低Kibra表达,可抑制Hippo信号通路异常激活。小鼠肾脏病理显示,与未干预的对照nphp1 KO小鼠相比,敲低Kibra的nphp1 KO小鼠肾囊肿形成显著减少、肾间质炎症和纤维化改善。研究揭示了Kibra-Hippo信号轴在NPH1发病中的重要作用,并可能成为NPH潜在的干预治疗靶点。
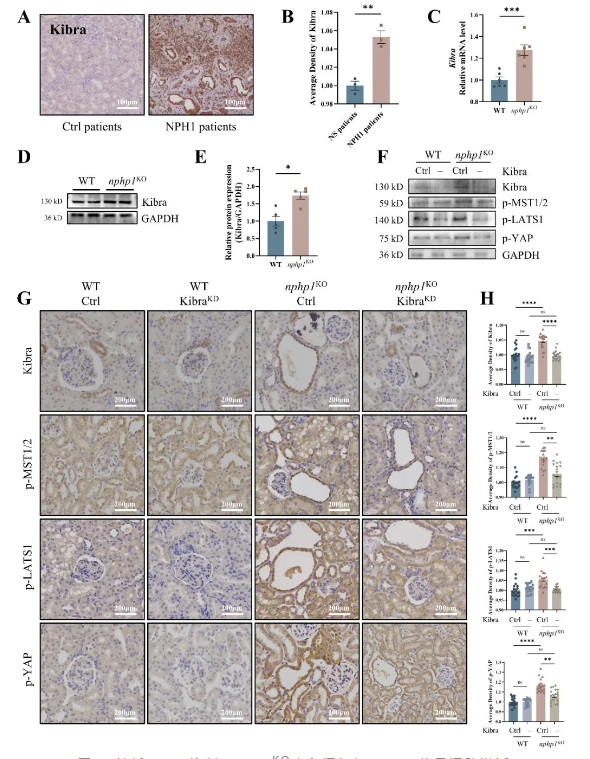
图1. 敲低Kibra抑制nphp1KO小鼠肾组织Hippo信号通路激活
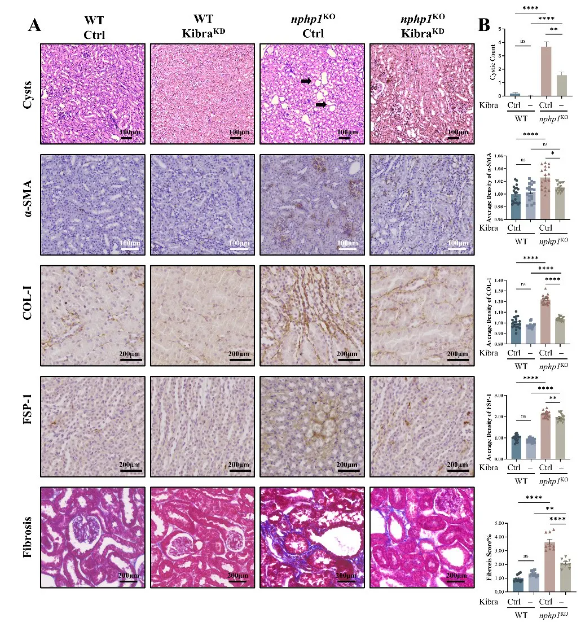
图2. 敲低Kibra抑制nphp1KO小鼠肾囊肿形成并改善肾间质炎症和纤维化
结论
nphp1缺陷导致经典Hippo通路异常激活;Kibra是其主要上游调节因子。Kibra-Hippo信号轴是调控NPH1发病的关键分子机制。
2月24日,南方医科大学南方医院儿科孙良忠教授团队在国际学术期刊《Clinical and Translational Medicine》在线发表了题为“Kibra knockdown inhibits the aberrant Hippo pathway, suppresses renal cyst formation and ameliorates renal fibrosis in nphp1 KO mice”的原创性研究论文。在这项研究中,研究人员探究了Kibra调控Hippo信号通路在nphp1缺陷肾消耗病(NPH1)发病机制中的作用。研究发现NPH1小鼠肾脏存在Hippo信号通路异常激活,Hippo信号通路上游调控因子Kibra显著高表达。在NPH1患儿的肾脏组织,研究者也发现Kibra高表达和Hippo信号通路异常激活。在nphp1缺失的MDCK细胞系,敲低Kibra可以抑制Hippo信号通路激活,改善肌动蛋白细胞骨架重构。在NPH1小鼠模型中敲低Kibra不仅可抑制Hippo信号通路异常激活,还可显著减少肾囊肿形成、改善肾纤维化和炎症。研究揭示了Kibra-Hippo信号轴在nphp1缺失疾病发生发展的关键作用。Kibra-Hippo信号轴将有可能成为治疗肾消耗病的潜在靶标。该研究末位通讯作者是南方医科大学南方医院儿科孙良忠主任医师,第一和共同第一作者分别是其硕士研究生杨翌晨、八年制博士薛志鹤和博士后赖佳泳。

论文链接: https://onlinelibrary.wiley.com/doi/10.1002/ctm2.70245
研究背景
肾消耗病(NPH)是一种常染色体隐性遗传性慢性间质性囊肿性肾病,占儿童和青少年终末期肾病(ESRD)病例的10%~20%。目前已发现20余种致病基因,其中nphp1是最主要的致病基因,占基因确诊患者的一半以上。近年来,随着基因诊断的推广,临床确诊NPH病例逐渐增多。但由于发病机制未明,目前尚无特效治疗手段。深入阐明肾消耗病的发病机制,对于开发创新且有效的治疗策略至关重要。
Hippo通路是一个进化上高度保守的细胞内信号转导途径,参与细胞增殖、凋亡、分化,调控组织器官大小和肿瘤发生等多种生物学过程。该通路由上游调节因子、核心分子和下游效应子组成。在哺乳动物中,上游调节因子包括Kibra、NF2和FRMD6,核心成分包括MST1/2、SAV1、LATS1/2及MOB1A/B,转录调节因子YAP和TAZ则是主要的下游效应子。
Hippo信号通路失调在多种纤毛病中被发现,但其作用因疾病而异。在多囊肾病(ADPKD),Hippo信号通路被抑制,肾囊肿生长不被抑制;在肾消耗病中,Hippo信号通路则过度激活,参与囊肿的形成。先前的研究发现nphp4、nphp9/Nek8、nphp3和nphp16/Anks6缺陷均可激活Hippo信号通路。但作为NPH最主要致病基因nphp1缺陷的Hippo信号通路情况及其在发病中的作用,此前并不清楚。
研究结果
孙良忠教授团队通过CRISPR基因编辑技术成功构建了nphp1敲除(nphp1 KO)的MDCK细胞及nphp1 KO C57BL/6J小鼠模型。研究团队发现Hippo通路在nphp1 KO MDCK细胞、nphp1 KO小鼠肾组织,以及NPH1患者肾活检组织中均被激活。通过质粒载体对nphp1 KO MDCK细胞进行nphp1的再表达,成功逆转了这些细胞中Hippo通路的激活,这表明Hippo通路的激活与nphp1 KO MDCK细胞中nphp1 的缺陷有关。
进一步研究发现,nphp1 KOMDCK细胞、nphp1KO小鼠和NPH1患者肾脏显著高表达上游激活因子Kibra。通过构建siRNA和AAV载体分别在MDCK细胞和小鼠模型中敲低Kibra表达,可抑制Hippo信号通路异常激活。小鼠肾脏病理显示,与未干预的对照nphp1 KO小鼠相比,敲低Kibra的nphp1 KO小鼠肾囊肿形成显著减少、肾间质炎症和纤维化改善。研究揭示了Kibra-Hippo信号轴在NPH1发病中的重要作用,并可能成为NPH潜在的干预治疗靶点。

图1. 敲低Kibra抑制nphp1KO小鼠肾组织Hippo信号通路激活

图2. 敲低Kibra抑制nphp1KO小鼠肾囊肿形成并改善肾间质炎症和纤维化
结论
nphp1缺陷导致经典Hippo通路异常激活;Kibra是其主要上游调节因子。Kibra-Hippo信号轴是调控NPH1发病的关键分子机制。
- 推荐文章
KI Rep丨达格列净联合托伐普坦延缓ADPKD病情进展:一项开放标签、随机、对照、交叉试验
肾域华章丨南方医科大学南方医院儿科孙良忠团队揭示肾消耗病关键发病机制
一文说清原发性膜性肾病蛋白尿缓解的传统和新兴预测因素
肾例明鉴 | 与IgA肾病及C3沉积相关的快速进展性肾小球肾炎合并慢性乙型肝炎病例一例
罕见但致命的肾小球病:一项英国多中心队列研究揭示纤维性肾小球病的临床特点与预后
泰它西普治疗儿童IgA肾病与IgA血管炎肾炎的疗效与安全性回顾分析
2025肾脏病学半年报:从突破性新药到异种移植,这些进展改写临床格局
生物标志物引领下的急性肾损伤精准诊疗:从困境到突破
以靶向治疗应对钙化防御:IL-6是关键突破口?
强直性脊柱炎还会“伤肾”吗?警惕强直性脊柱炎的肾脏损害
FDA扩大非奈利酮适应证,惠及更多心力衰竭患者
伊普可泮与Pegcetacoplan治疗原发性膜增生性肾小球肾炎的真实世界证据
研究者解读:CONFIDENCE试验——非奈利酮与恩格列净联合治疗的突破性发现
泰它西普治疗IgA肾病的研究进展:来自真实世界研究的数据
ERA前主席C. Wanner教授专访:心肾轴与慢性肾脏病管理新进展
来自Ⅲ期APPEAR-C3G研究的最新数据:伊普可泮快速持续改善C3水平、减少血尿和蛋白尿
肾例明鉴丨5旬肾友拿不住筷子、双手无力无感觉竟是因为它?透析15年以上几乎100%中招!
肾识百科丨IgA肾病患者必知:感染如何“兴风作浪”及防范之策
特应性皮炎竟是IgA肾病“隐形推手”,银屑病关联成谜引学界热议
JASN丨首个针对C3肾小球病患者使用C5a受体阻断剂阿伐可泮的ACCOLADE研究结果公布
赵建荣教授:髓质海绵肾研究新进展
NDT丨IgA肾病患者时间平均UPCR>2 g/g,肾脏复合终点事件风险达41.2
慢性肾病进展快?《延缓慢性肾脏病进展临床管理指南(2025年版)》揭秘6大延缓妙招,护肾关键全在这!
2025年ERA关于IgA肾病的这些新证据您可能不知道
首次揭示红斑狼疮持续缓解至少3年,可显著降低LN及总体器官累积损伤风险
大型亚洲队列研究新鲜出炉:CKM综合征65.8%处于1~2期,显著增加患者心肾死亡风险、缩短预期寿命
肾例明鉴 | 两例IgG4相关性肾病合并单克隆丙种球蛋白病的诊疗解析及文献回顾
ERA 2025伊普可泮治疗IgA肾病相关研究进展
年纪轻轻肾就坏了?了解罕见的青少年肾单位肾痨-髓质囊肿病,揭开医学谜题
ALIGN研究事后分析揭示阿曲生坦对IgA肾病亚组蛋白尿的降低作用
APSN前任主席Sydney Tang教授:SPARTACUS试验的临床意义及IgA肾病治疗进展
ERA 2025替那帕诺研究:破解血液透析患者高磷血症管理新密码
聚焦肾脏与大脑健康的跨学科探索——2025年Eberhard Ritz临床科学奖获得者专访
NPT2b缺陷通过恢复线粒体功能和抑制肾小管上皮细胞部分上皮-间质转化减轻肾小管间质纤维化
张凌教授:局部枸橼酸抗凝的进展与突破
全球肾脏疾病研究新进展及未来方向——ERA论文遴选委员会主席R. Gansevoort教授专访
CCBPC 2025丨涂晓文教授:脓毒症相关AKI的血液净化治疗进展与思考
CCBPC 2025丨马坤岭教授:急性肾损伤新型治疗策略探索
肾例明鉴丨咳嗽咯血也可能是肾病?男子咳嗽咯血,想不到是这种危重凶险肾病惹的祸
免疫细胞代谢在膜性肾病中的作用及治疗前景
肾识百科|潜伏体内的“沉默杀手”:尿毒症的致命真相
大咖访谈丨聚焦IgA肾病前沿与创新——国际权威专家共探诊疗未来
糖尿病合并严重CKD患者HbA1c水平维持在6.7%~7.1%,对于降低长期并发症和死亡风险最为有利
北大一院最新GWAS研究揭晓膜性狼疮肾炎的遗传易感性基因,为解析LN亚型的遗传异质性提供了重要依据
Renal Failure丨PLA2R相关特发性膜性肾病的潜在诊断生物标志物初步揭晓
SONAR研究事后分析:内皮素受体拮抗剂阿曲生坦显著改善T2D合并CKD患者的胰岛素敏感性
Kidney360|IgA肾病中肾小球重度C3沉积显著增加肾脏替代治疗风险
首届肾小球疾病中外大咖面对面(CIG)会议聚焦IgA肾病治疗的精准探索与未来展望
肾例明鉴 | 较为遗憾的一个病例——老人慢性肾病基础上出现急性肾损伤,肾功能急剧恶化,进展为不可逆尿毒症
欧洲肾脏协会发展与肾脏病学前沿进展 | ERA大咖谈
糖尿病肾病管理的多重突破与挑战 | ERA大咖谈
透析患者使用盐皮质激素受体拮抗剂:疗效争议与研究新方向 | ERA大咖谈
PROTECT试验开放标签扩展期数据公布:Sparsentan为ARB治疗后的IgA肾病患者带来新希望
CKD前沿研究:从药物流行病学到GFR精准估算 | ERA大咖谈
ERA中国之声丨陈舜杰教授、杨明博士:不是“葡萄串”,而是“香蕉状”!ADPKD囊肿的索状三维结构支持肾小管梗阻新假说
