- 首页 > 正文
千人千面?基于临床表型的IgA肾病个体化治疗策略
发表时间:2026-02-04 09:35:52
编者按
IgA肾病(IgAN)作为全球最常见的原发性肾小球疾病,其临床表现高度异质,既包括典型的轻度蛋白尿伴镜下血尿,也包括进展迅速的肾功能恶化、肉眼血尿相关急性肾损伤(AKI)、肾病综合征等少见表型。近年来,随着多种新型靶向药物的问世,IgAN的治疗策略正发生深刻变革。西班牙康普顿斯大学医学系Manuel Praga等[1]基于最新证据和专家共识,提出了不同临床情境下的个体化治疗算法,强调将临床表型、组织学特征与药物作用机制相匹配是优化IgAN管理的关键。
一、临床与组织学因素对IgAN结局的影响
蛋白尿一直是IgAN预后评估和疗效判断的核心指标。早期研究认为1 g/d是较为安全的蛋白尿控制目标,患者大多病情稳定;而最新证据提示即便蛋白尿水平低于0.5 g/d甚至低于0.3 g/d也可能与不良预后相关,提示疾病活动。蛋白尿作为预后标志物的局限性在于,其可能反映的是以往炎症发作所致的慢性不可逆性损害,而非当前活动性肾小球病变。
血尿是IgAN的另一典型特征。血尿(特别是持续性镜下血尿)的长期影响近年来逐渐受到重视。已有研究证实其与ESKD风险显著相关,随访期间血尿的均值越高,进展为ESKD的风险越大;相反,无论是自发缓解还是治疗诱导的血尿缓解,通常伴随肾功能的稳定。然而,血尿评估方法的差异性限制了其作为RCT纳入标准或替代终点的广泛应用。目前推荐采用显微镜检查尿沉渣,评估每高倍视野红细胞数(RBC/HPF)以量化血尿程度。此外,尿试纸和自动化尿液分析仪也被认为是可接受的方法。
研究表明,同时存在显著蛋白尿和持续性血尿的患者预后最差;而仅有蛋白尿无血尿,或单纯血尿的患者,预后明显更好。虽然尚缺乏确凿证据,但血尿的有无可能有助于区分蛋白尿的来源——是源于活动性免疫/炎症反应,还是慢性肾损伤的残留表现。
病理方面,Oxford MEST-C评分系统将IgAN的组织学改变分为:系膜细胞增生(M)、毛细血管内细胞增生(E)、节段性硬化(S)、间质纤维化/小管萎缩(T)和新月体(C)等五类,其对预后具有决定性意义。其中,M、E、C属于活动性病变,可能对免疫抑制或免疫调节治疗有反应;而S、T代表慢性病变,一般对上述治疗不敏感。
二、IgAN标准治疗与新兴方案
为每位IgA肾病(IgAN)患者制定治疗策略时,应综合考量多个关键因素。第一,并非所有IgAN患者的疾病均呈进行性进展。若患者仅表现为轻度尿异常(蛋白尿<0.5 g/d,伴显微镜下血尿)且肾功能正常,则其长期预后良好。而亚洲患者的预后可能更差。第二,STOP-IgAN试验(NCT00554502)表明,相当一部分患者通过生活方式干预和非免疫抑制治疗即可实现短期缓解。第三,蛋白尿水平历来是纳入RCT和评估治疗反应的主要甚至唯一标准,其他关键临床参数(如血尿、eGFR下降速率、组织学特征或临床表现类型)在前瞻性试验中尚未被充分纳入考量。第四,必须重视不同治疗方案的作用机制,这些方案大致可分为三类:生活方式干预、非免疫抑制治疗、免疫抑制/免疫调节治疗。
1. 生活方式干预与非免疫抑制治疗
生活方式干预:规律运动、体重控制、戒烟等基本生活方式措施,是IgAN管理的重要组成部分,适用于所有患者,并应严格执行与动态评估。
RAS抑制剂:RASi(ACEI或ARB)是IgAN一线治疗基石,可显著降低蛋白尿并延缓肾功能进展。RASi治疗应个体化滴定,目标为蛋白尿<0.3 g/d,收缩压<130 mmHg。必要时可加用MRA或噻嗪类利尿剂以增强降蛋白尿效应。
钠-葡萄糖共转运蛋白2抑制剂(SGLT2i):EMPA-KIDNEY与DAPA-CKD研究证实,SGLT2i可减缓eGFR下降,适用于eGFR下降但未接受免疫抑制的IgAN患者。近期回顾性研究显示其亦能显著降低蛋白尿。
内皮素受体拮抗剂(ERA):PROTECT试验显示,司帕生坦(sparsentan)在降低蛋白尿和减缓肾功能恶化方面优于传统ARB,司帕生坦使UPCR下降42.8%,而厄贝沙坦仅下降4.4%;两年eGFR下降幅度方面,司帕生坦组为-2.9 ,厄贝沙坦组为-3.9 ml/min。司帕生坦已获FDA和EMA批准。新一代ERA如阿曲生坦(atrasentan)也显示良好前景。
MRA(盐皮质激素受体拮抗剂):非类固醇MRA(如非奈利酮)在CKD患者中具有抗蛋白尿效应,有望成为IgAN辅助治疗选择。
2. 免疫抑制与靶向治疗选择
糖皮质激素:糖皮质激素除可直接作用于足细胞骨架,还具有广泛的抗炎效应。多项RCT及回顾性研究证实其可改善IgAN患者的肾脏结局。TESTING试验显示,低剂量甲泼尼龙可降低进展至ESKD风险,但需权衡不良反应风险。推荐方案为:0.4 mg/kg/d,最大32 mg/d,逐渐减量,6~9个月减停。
MMF(吗替麦考酚酯):MMF及其代谢产物MPAA具有抑制淋巴细胞增殖、抗炎及抗纤维化作用,并可抑制系膜细胞增生。MMF在中国患者中疗效确切,单药或与低剂量激素联合应用均优于激素单药,尤适用于伴血尿的活动性IgAN患者。KDIGO指南目前仅推荐在中国患者中使用MMF,但部分白人患者中也有阳性数据。
靶向释放布地奈德(耐赋康,Nefecon):耐赋康旨在靶向释放布地奈德至回肠远端,该部位富含产生致病IgA的淋巴组织。NefIgArd试验显示,耐赋康在RASi治疗后仍有蛋白尿(>1 g/d)患者中可显著减少50%的蛋白尿,且对血尿缓解有积极作用。
APRIL/BAFF通路抑制剂:APRIL和BAFF是促进B细胞增殖的重要因子,其中APRIL水平在IgAN患者中显著升高。研究显示,斯贝利单抗(sibeprenlimab)显著降低蛋白尿、稳定eGFR、缓解血尿,并减少半乳糖缺陷IgA1水平,且安全性良好。APRIL/BAFF抑制剂有望成为IgAN一线治疗选择。
补体抑制剂:补体系统在IgAN的发病机制中发挥关键作用。靶向补体不同环节的抑制剂(伊普可泮[iptacopan]、ravulizumab和cemdisiran)在Ⅱ期RCT研究中表现出色,Ⅲ期试验中期分析中,伊普可泮与安慰剂相比显著降低蛋白尿水平。
羟氯喹:羟氯喹为一种抗疟药,具有通过抑制Toll样受体实现的免疫调节作用。一项中国小样本RCT显示,羟氯喹治疗6个月后可显著降低IgAN患者的蛋白尿水平。
三、基于表型的IgAN治疗路径:专家共识方案
表型一:蛋白尿±镜下血尿
初始治疗:生活方式干预 + RASi ± MRA/噻嗪(图1)。
若3~6月后蛋白尿仍>0.3 g/d,建议加用SGLT2i。若仍蛋白尿明显,治疗选择依据是否伴持续性血尿而定:(1)若严重的蛋白尿持续存在但无明显血尿,建议加用司帕生坦,同时,停用RASi;(2)若有明显蛋白尿和血尿,尤其是肾活检发现存在活动性病变,推荐应用皮质类固醇 + MMF、耐赋康或激素单药治疗。
对于上述免疫抑制治疗难治的侵袭性病例,建议考虑参加新疗法的临床试验,或开始使用抗APRIL/BAFF药物或补体阻滞剂治疗。
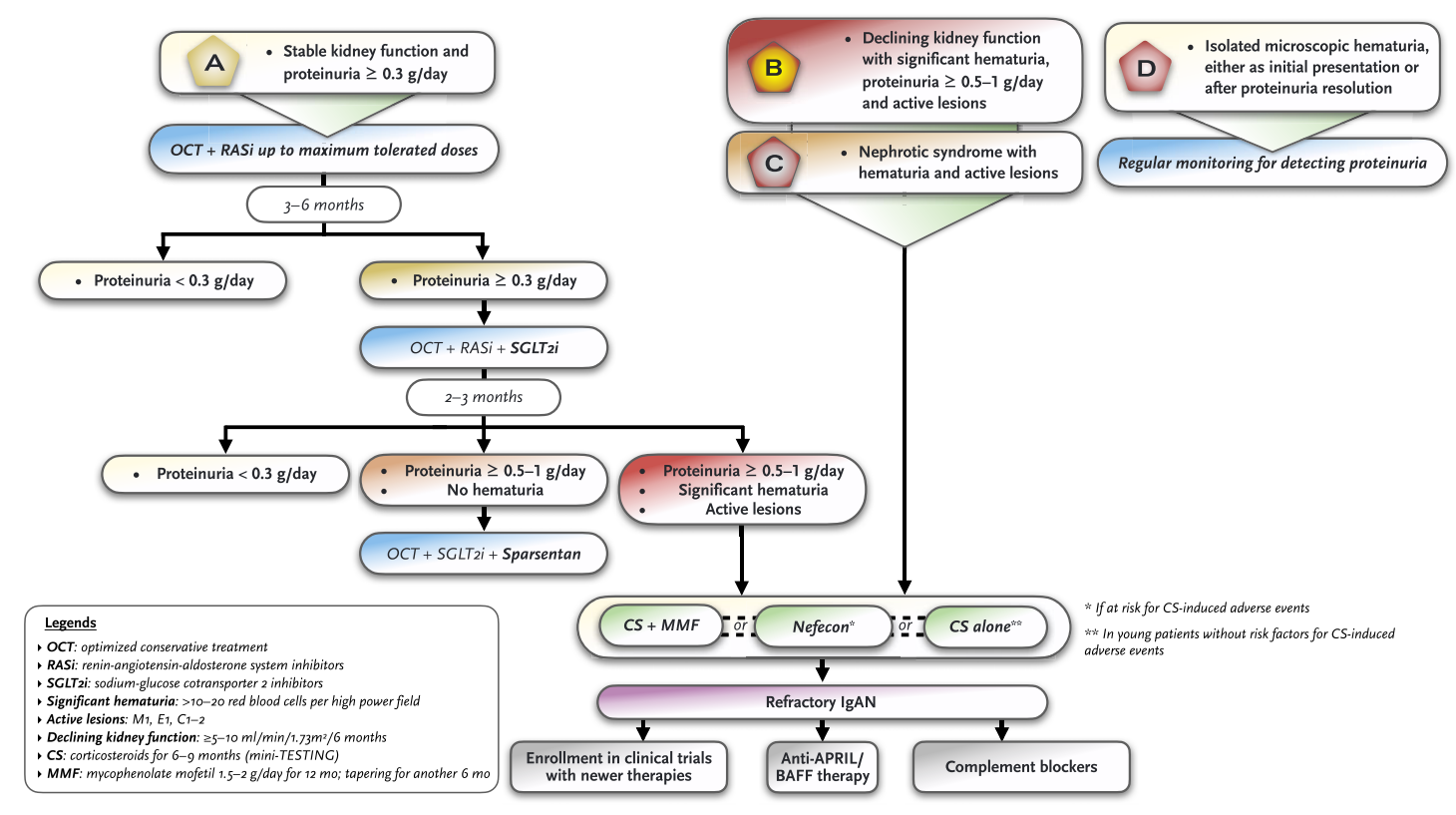
图1. 伴或不伴肾功能下降的蛋白尿/血尿患者的治疗流程
表型二:肉眼血尿
高达40%~50%的IgAN患者将肉眼血尿发作视为该病的首发表现。如果肉眼血尿持续时间>5天,建议重复实验室检查,血尿持续>1周考虑肾活检。待血尿缓解后应重新评估。若血尿缓解后仍存在显著蛋白尿和显微镜下血尿,通常需行肾活检以明确诊断。部分患者血尿发作时合并不同程度的AKI,须行肾活检以排除其他诊断。若确认为IgAN,最常见病理特征为肾小管腔内红细胞管型,提示血红蛋白相关肾小管损伤是AKI的主要机制。
肉眼血尿相关AKI的管理应以支持治疗为主(图2)。需特别关注患者是否合并抗凝治疗,因IgAN是抗凝相关AKI最常见的基础肾病。
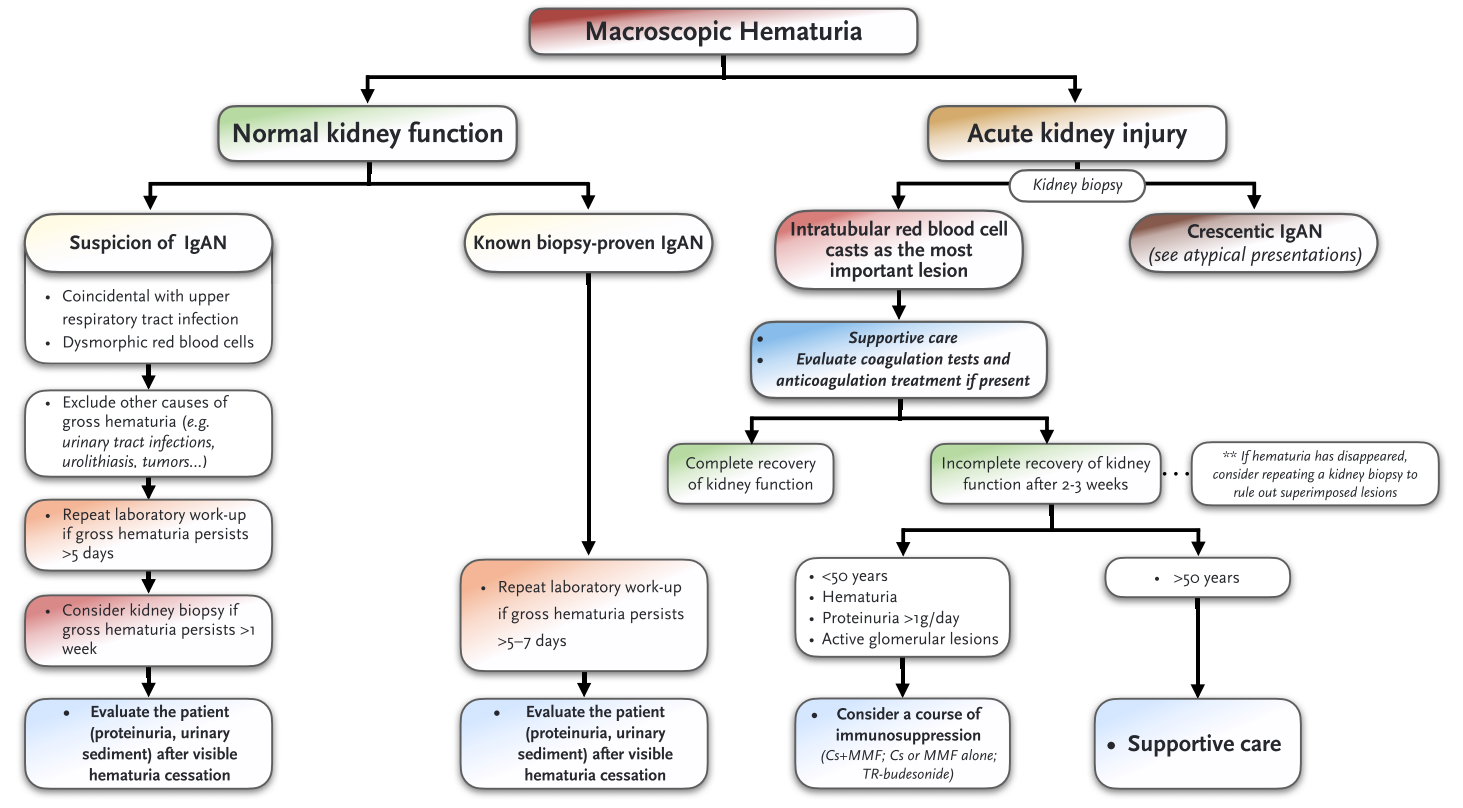
图2. 肉眼可见血尿患者的治疗建议
表型三:非典型IgAN表现(图3)
快速进展型/新月体性IgAN(RPIgAN):指eGFR在3个月内下降>50%,肾活检中>30%的肾小球出现新月体。观察性研究提示甲泼尼龙冲击联合口服泼尼松和环磷酰胺(口服或静脉)可能有效。对于虽不符合RPIgAN诊断标准但肾功能下降迅速者,糖皮质激素联合MMF亦有一定疗效。总体而言,RPIgAN预后较差,5年内>70%患者进展至ESKD。
需注意区分RPIgAN与肉眼血尿相关AKI。后者主要病理特征为肾小管内RBC管型及急性肾小管坏死,偶见新月体但比例<30%。
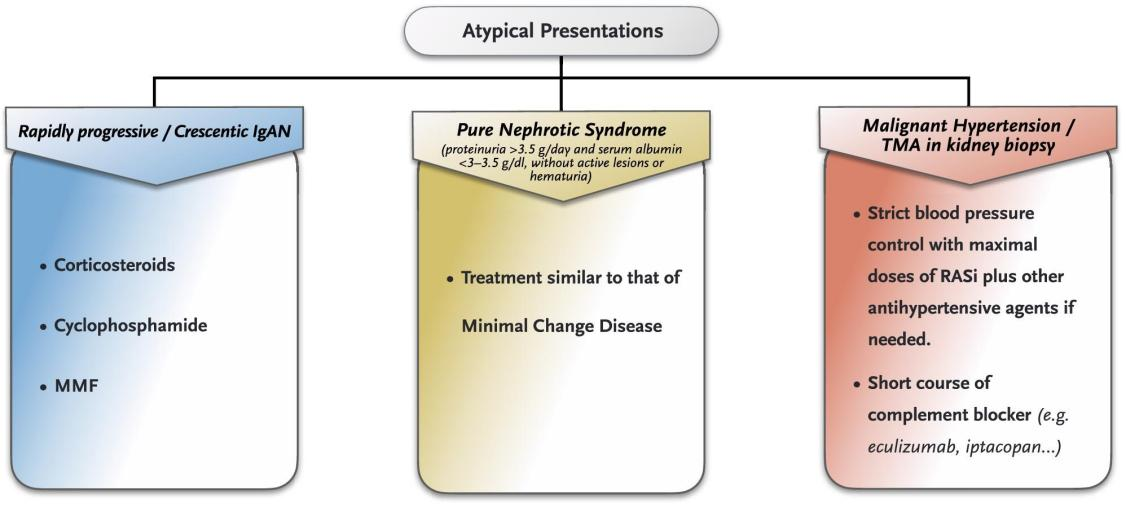
图3. IgAN的非典型表现
肾病综合征(大量蛋白尿、低白蛋白血症):肾活检提示以IgA为主或唯一沉积,C3沉积少或无,系膜细胞增生轻微或无,电镜可见广泛足细胞融合。这类患者对糖皮质激素反应良好,病程类似微小病变肾病。
恶性高血压(眼底出血/渗出):是IgAN的罕见表现。预后极差,多数进展至ESKD,免疫抑制并不改善结局。TMA病变在此类患者中常见,但典型血液TMA表现较少。补体异常被认为与TMA发病相关,表现为C4d、C3d、C5b-9等沉积以及致病性补体基因突变。强化降压(以RASi为主)为基础治疗;短疗程补体抑制剂可能有益,但缺乏RCT支持。
表型四:妊娠合并IgAN
妊娠前或妊娠早期若蛋白尿>1 g/d,预示不良妊娠结局风险升高,建议在疾病缓解期计划妊娠。RASi、SGLT2i和司帕生坦应停用。
建议低剂量阿司匹林预防子痫前期。妊娠期若蛋白尿显著加重,需评估是否为RASi停用、妊娠高滤过、体重增加等因素所致。20周后可用sFlt-1/PlGF比值鉴别是否为子痫前期。若有血尿复发及蛋白尿升高迹象,可考虑短程糖皮质激素或硫唑嘌呤治疗。以蛋白尿为主者也可尝试他克莫司。
表型五:移植肾复发IgAN
建议定期检查尿沉渣,疑似复发应行移植物活检,若确诊复发,参照MEST-C评分进一步评估。
治疗策略:优先采用OCT + RASi至最大耐受剂量。若蛋白尿≥0.3 g/d持续存在,建议加用SGLT2i。若蛋白尿≥0.5~1 g/d,且无显著血尿或肾功能恶化,可尝试司帕生坦。若蛋白尿≥0.5~1 g/d、显著血尿和/或活跃病变,建议更激进治疗策略,可包括糖皮质激素冲击(0.5–1 g/d,持续1~3天),加用耐赋康可能是有前景的选择。可联合MMF加量。若合并TMA病变,则补体阻断治疗(如伊普可泮)或抗C5单抗可能更合适。
结语
IgAN的临床表现高度异质,而这些非典型表型在多数临床试验中尚未被充分代表。IgAN的治疗进入多路径精准时代,不同表型的识别和靶向治疗选择尤为关键。尽管蛋白尿水平仍是指导治疗决策的重要依据,但在制定最优治疗方案时,也应综合考虑血尿的存在与程度、MEST-C评分下的组织学改变,以及肾功能进展情况。同时,对于现有药物的作用机制也应进行全面评估,以便选择最合适的治疗路径或药物组合。本文所列算法结合蛋白尿、血尿、组织学分型及药物作用机制,旨在为临床制定更具个体化、循证依据的治疗策略。
来源:Manuel Praga, et al. Tailored management strategies for IgA nephropathy based on clinical presentations. Nephrology Dialysis Transplantation, Volume 40, Issue 5, May 2025, Pages 874–883.
- 推荐文章
