- 首页 > 正文
肾域华章 | 浙大二院等的研究:Sirt1通过抑制NLRP3信号通路保护狼疮性肾炎的机制探讨
发表时间:2026-02-04 09:48:28
摘要
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)最常见且最严重的器官并发症之一,其发病机制复杂,炎症反应及免疫调节失衡在其中起关键作用。浙江大学医学院附属第二医院风湿科、宁波市鄞州第二医院肾内科、宁波大学附属第一医院重症监护室的专家学者在Open Life Sci. 联合发表了一篇文章,旨在探讨Sirtuin1(Sirt1)在LN中的表达变化及其通过调控NLRP3信号通路对人肾小球系膜细胞(GMCs)的保护作用。研究显示LN患者肾组织中Sirt1表达显著下调,而LN患者血清可诱导GMCs发生氧化应激、细胞凋亡及线粒体损伤,并激活NLRP3炎症小体信号通路。过表达Sirt1可有效抑制上述病理过程,提示Sirt1可能通过负调控NLRP3通路发挥对LN的保护作用,为LN的治疗提供了潜在新靶点(图1)。
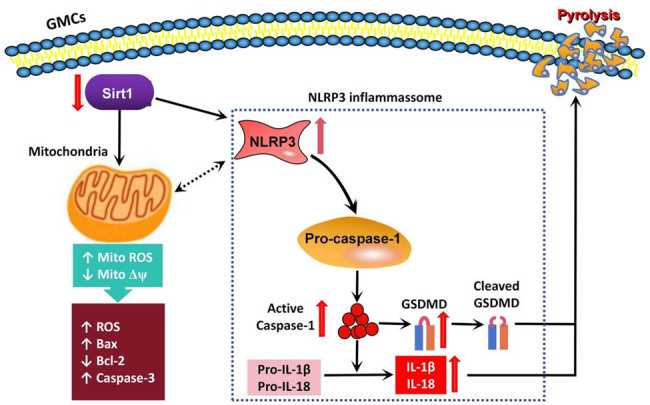
系统性红斑狼疮(SLE)是一种由免疫耐受障碍引起的自身免疫性疾病,发病机制涉及T、B淋巴细胞功能紊乱、免疫复合物沉积及补体激活等。狼疮性肾炎(LN)是SLE最具危害性的并发症之一,约40%~60%的SLE患者最终会累及肾脏,表现为蛋白尿、血尿、高血压、肾功能减退甚至终末期肾病。尽管当前LN的免疫抑制治疗方案不断优化,但由于其病理机制仍未完全明确,部分患者疗效不佳或病情反复。
近年来,Sirtuin家族蛋白在多种疾病中的调控作用受到广泛关注。Sirt1是一种NAD+依赖性去乙酰化酶,广泛参与细胞应激反应、代谢稳态、炎症调控及衰老等过程。已有研究显示,Sirt1在慢性肾病、糖尿病肾病等中具有重要的保护作用。然而,其在LN中的表达变化及作用机制尚未阐明,特别是是否通过调控NLRP3炎症小体信号通路发挥作用仍需深入探讨。
材料与方法概述
本研究纳入10例经肾穿确诊的LN患者及10例肾外伤手术患者作为对照,获取血清和肾组织样本。通过免疫组化、实时荧光定量PCR(qPCR)、Western blot等方法检测Sirt1的表达水平。同时,采用LN患者血清处理人GMCs,构建Sirt1过表达和沉默模型,评估其对氧化应激、凋亡、线粒体功能及NLRP3通路相关蛋白表达的影响。
研究结果
1. LN患者肾组织中Sirt1表达水平显著下降
研究发现,与正常对照相比,LN患者肾组织中Sirt1蛋白及mRNA表达水平均显著下调,且主要分布于肾小球及肾小管区域。同时,LN患者血清肌酐(Scr)、尿素氮(BUN)、pKIM-1水平均升高,病理表现为节段性硬化、间质纤维化及炎细胞浸润,提示肾脏功能显著受损(图2)。
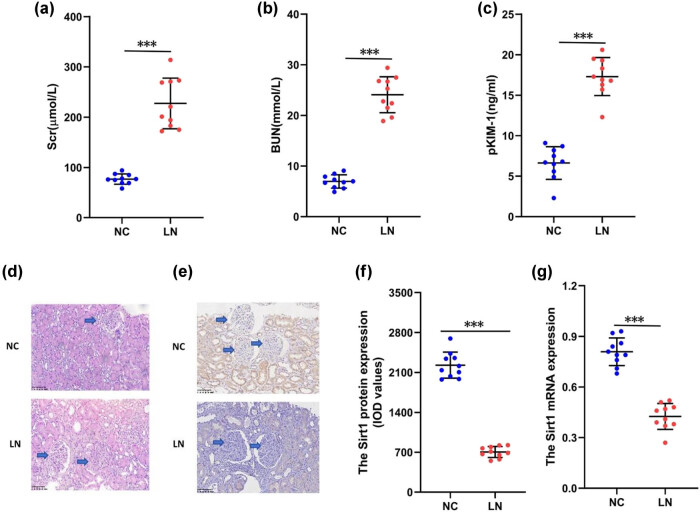
图2. LN患者肾组织中Sirt1的表达(a)血清肌酐(Scr)水平;(b)血尿素氮(BUN)水平;(c)血浆肾损伤分子-1(pKIM-1)水平;(d)肾脏病理(×400);(e)Sirt1蛋白表达(×400);(f)Sirt1蛋白水平;(g)Sirt1 mRNA-表达。与LN组相比,*P<0.05,**P<0.01,***P<0.001。Sirt1:sirtuin1;Scr:血清肌酐;BUN:血尿素氮;pKIM-1:血浆肾损伤分子-1。
2. Sirt1抑制GMCs氧化应激反应
氧化应激是LN进展中的重要机制。LN患者血清处理GMCs可显著提高细胞内活性氧(ROS)水平,升高丙二醛(MDA)表达,并降低谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)水平。Sirt1沉默可进一步加重氧化损伤,而过表达Sirt1可显著逆转上述变化,提示其具有明显的抗氧化应激作用(图3)。
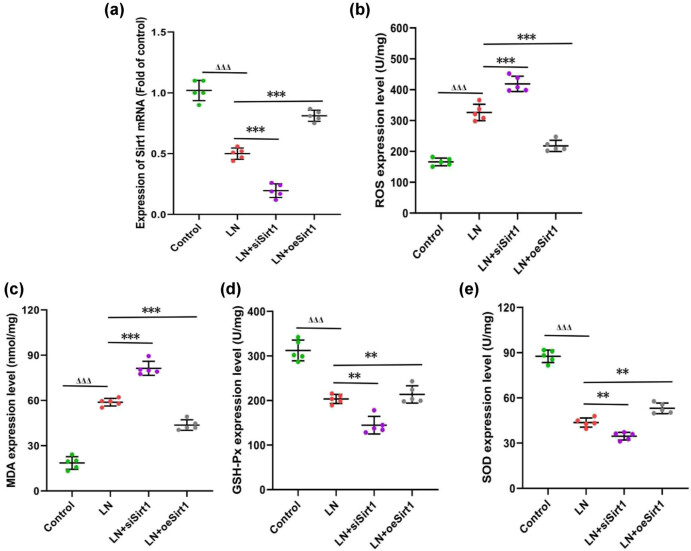
图3. Sirt1抑制肾小球系膜细胞(GMCs)中的氧化应激(a) 不同实验组中Sirt1的表达;(b) GMCs中活性氧(ROS)的水平;(c) 丙二醛(MDA)的水平;(d) 谷胱甘肽过氧化物酶(GSH-Px)的水平;(e) 超氧化物歧化酶(SOD)的水平。与对照组相比,ΔΔΔ 表示 P < 0.001;与LN组相比,**表示 P < 0.01,***表示 P < 0.001。GMCs:人肾小球系膜细胞;ROS:活性氧;MDA:丙二醛;GSH-Px:谷胱甘肽过氧化物酶;SOD:超氧化物歧化酶。
3. Sirt1抑制GMCs细胞凋亡
凋亡在LN的组织损伤中起关键作用。流式细胞术及相关基因表达分析显示,LN血清可诱导GMCs凋亡增加,促凋亡蛋白Bax、Caspase-3表达上调,抗凋亡蛋白Bcl-2下调。Sirt1沉默加剧这一过程,而其过表达可显著抑制细胞凋亡,恢复凋亡相关基因表达的平衡(图4)。
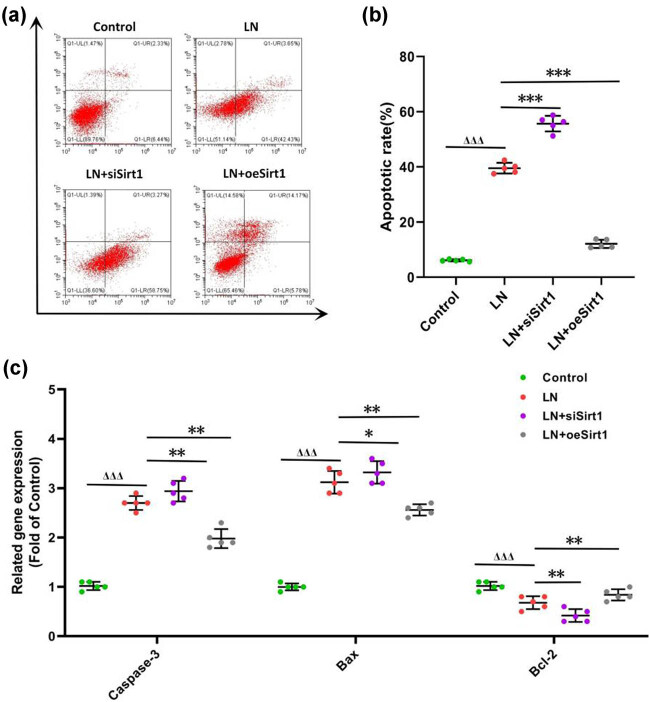
图4. Sirt1抑制肾小球系膜细胞(GMCs)的凋亡(a) GMCs的凋亡情况;(b) GMCs的凋亡率;(c) 凋亡相关基因的表达情况。与对照组相比,ΔΔΔ 表示 P < 0.001;与LN组相比,*表示 P < 0.05,**表示 P < 0.01,***表示 P < 0.001。GMCs:人肾小球系膜细胞。
4. Sirt1维持GMCs线粒体结构与功能稳定
线粒体是调控细胞能量代谢与凋亡的核心器官。在LN条件下,GMCs线粒体膜电位下降,结构不规则,部分膜结构破裂,线粒体复合酶活性显著下降。Sirt1过表达可保护线粒体形态结构,增强复合酶I与Ⅳ的活性,提高膜电位,维持线粒体功能稳定(图5)。
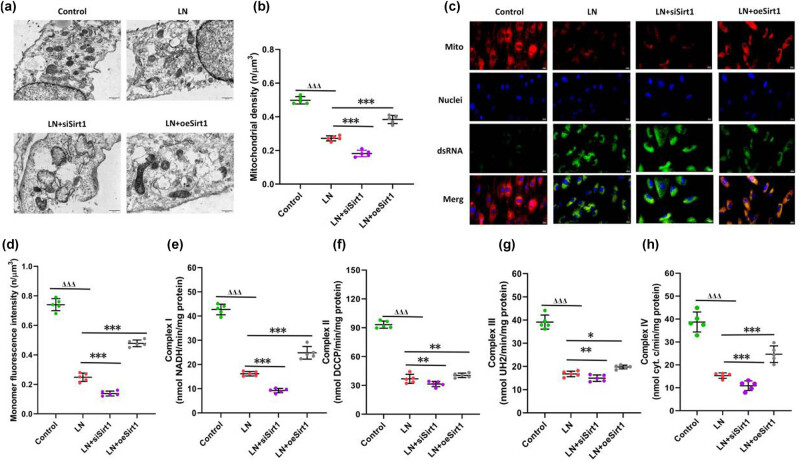
图5. Sirt1保护肾小球系膜细胞(GMCs)的线粒体功能(a) 线粒体形态的观察;(b) 线粒体密度的变化;(c) 线粒体膜电位的变化;(d) 线粒体膜电位的定量变化;(e) 线粒体复合酶I的变化;(f) 线粒体复合酶Ⅱ的变化;(g) 线粒体复合酶Ⅲ的变化;(h) 线粒体复合酶Ⅳ的变化。与对照组比较,ΔΔΔ 表示 P < 0.001;与LN组比较,*表示 P < 0.05,**表示 P < 0.01,***表示 P < 0.001。GMCs:人肾小球系膜细胞。
5. Sirt1通过抑制NLRP3信号通路发挥抗炎作用
NLRP3炎症小体是介导LN炎症反应的关键通路。研究发现,LN血清可显著上调GMCs中NLRP3、Caspase-1及GSDMD蛋白表达,促进IL-1β与IL-18的释放。Sirt1沉默加剧上述炎症反应,而其过表达可显著降低上述指标的表达水平,提示Sirt1可通过负向调控NLRP3炎症通路发挥抗炎作用(图6)。
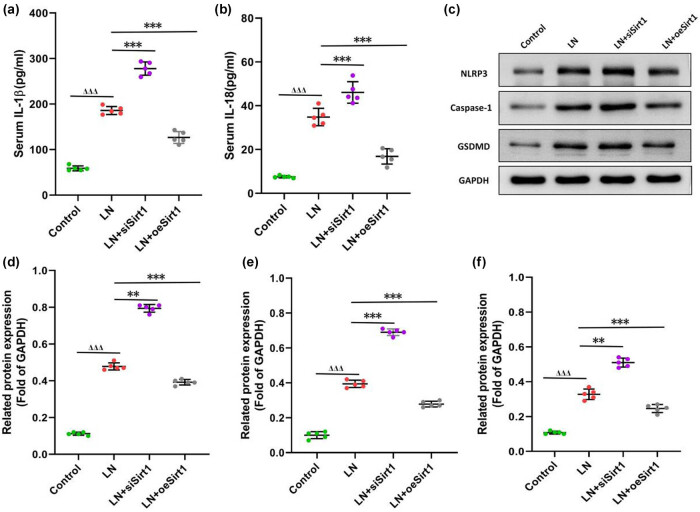
图6. Sirt1抑制肾小球系膜细胞(GMCs)中的NLRP3信号通路(a) 白细胞介素-1β(IL-1β)的水平;(b) 白细胞介素-18(IL-18)的水平;(c) NLRP3信号通路相关蛋白的表达;(d) NLRP3蛋白水平;(e) Caspase-1蛋白水平;(f) GSDMD(气体皮质样蛋白D)蛋白水平。与对照组比较,ΔΔΔ 表示 P < 0.001;与LN组比较,**表示 P < 0.01,***表示 P < 0.001。GMCs:人肾小球系膜细胞。
讨论
本研究首次系统性地揭示了Sirt1在LN发病机制中的多重保护作用。Sirt1不仅抑制了LN诱导的氧化应激和细胞凋亡,还通过维护线粒体结构和功能稳定、抑制NLRP3通路的激活,从而减轻了肾组织的损伤。相关研究也证实,Sirt1可通过调控下游因子FOXO1、PGC-1α等调节氧化应激与线粒体稳态。此外,Sirt1与NF-κB、STAT3等转录因子的相互作用也是其发挥抗炎与免疫调节作用的重要机制之一。
尽管本研究提供了明确的实验依据,但仍存在一定局限性。首先,研究主要聚焦于GMCs,未涉及肾小管上皮细胞或其他免疫细胞;其次,Sirt1的下游通路仍需在动物模型中进一步验证;此外,是否可通过小分子激动剂或抑制剂靶向Sirt1治疗LN亦值得进一步探索。
结论Sirt1在LN发病机制中发挥多重保护作用,其机制可能包括抑制氧化应激反应、减少细胞凋亡、保护线粒体功能及抑制NLRP3炎症小体的激活。因此,Sirt1可能成为未来LN治疗的潜在新靶点。
来源:Open Life Sci. 2025 Apr 25;20(1):20221038. doi: 10.1515/biol-2022-1038. eCollection 2025.
- 推荐文章
