- 首页 > 正文
RNA疗法在肾脏疾病中的应用前景与现状
发表时间:2026-02-04 10:03:34
编者按
RNA疗法作为一类新兴精准医疗策略,近年逐渐在多种罕见病与先天性疾病中展现出广阔前景。尤其在肾脏疾病领域,RNA干扰(RNA interference,RNAi)技术、短干扰RNA(siRNA)、反义寡核苷酸(ASO)以及微小RNA(miRNA)等手段,已逐步进入临床研究与药物开发阶段,为治疗Alport综合征、多囊肾病、肾细胞癌等疾病提供新契机。
近日,Clinical Kidney Journal上在线发表一篇文章,综述了RNA疗法在肾脏相关疾病中的作用机制、临床研究进展及其面临的挑战,并聚焦已获美国FDA与欧洲EMA批准或正在审评的RNA类药物,为相关疾病的未来治疗提供科学依据。本文整理核心内容与读者共享。
一、RNA干扰的生物学机制
RNA干扰是一种由小非编码RNA介导的基因沉默机制。其主要执行因子包括微小RNA(miRNAs)、短干扰RNA(siRNAs)、PIWI相互作用RNA(piRNAs)以及一类Argonaute(Ago)蛋白。这些因子共同构成RNA诱导沉默复合物(RISC)(图1),通过与靶mRNA结合引导其降解或抑制翻译,进而调控基因表达。
miRNA和siRNA的生物合成机制和功能作用具有共同特征,而piRNA在这些方面有所不同。具体而言,miRNA与siRNA均来源于双链前体RNA,随后经历各种成熟阶段以形成单链形式,而piRNA前体是单链RNA。在成熟过程结束时,miRNA和siRNA的长度为18~25个核苷酸,而piRNA则更长,为21~30个核苷酸。PIWI蛋白主要在生殖细胞中被发现,因此piRNA具有组织特异性,在配子发生和生殖过程中起着关键作用;相比之下,miRNA和siRNA分布广泛,miRNA参与内源性基因的沉默,而siRNA主要在防御基因组完整性以免受外源因素(如转座子和病毒)侵害方面发挥作用。
就作用机制而言,其关键过程是将miRNA或siRNA加载到Ago蛋白中,将piRNA加载到PIWI蛋白中,形成RNA诱导的沉默复合体(RISC),从而可以精准结合并调控靶mRNA。Ago蛋白在RISC中起着关键作用,这是由于Ago蛋白的PAZ结构域参与小RNA(sRNAs)与靶标的结合,而Ago蛋白的PIWI结构域具有内在的核酸内切酶活性,两者共同促成了RISC的沉默功能。这两种单链分子(miRNA或siRNA与piRNA)之间的结合可以是完全互补或部分互补的。完全互补会导致mRNA切割,随后在细胞外切酶的作用下降解。在部分互补的情况下,RISC会抑制翻译。RNAi通路的这两种作用机制对多种生物学功能有显著影响,如细胞的发育、增殖、分化和凋亡。RNAi机制组件的表达失调会导致多种病理状态的发生,如心血管疾病、肾脏疾病、代谢紊乱和癌症。
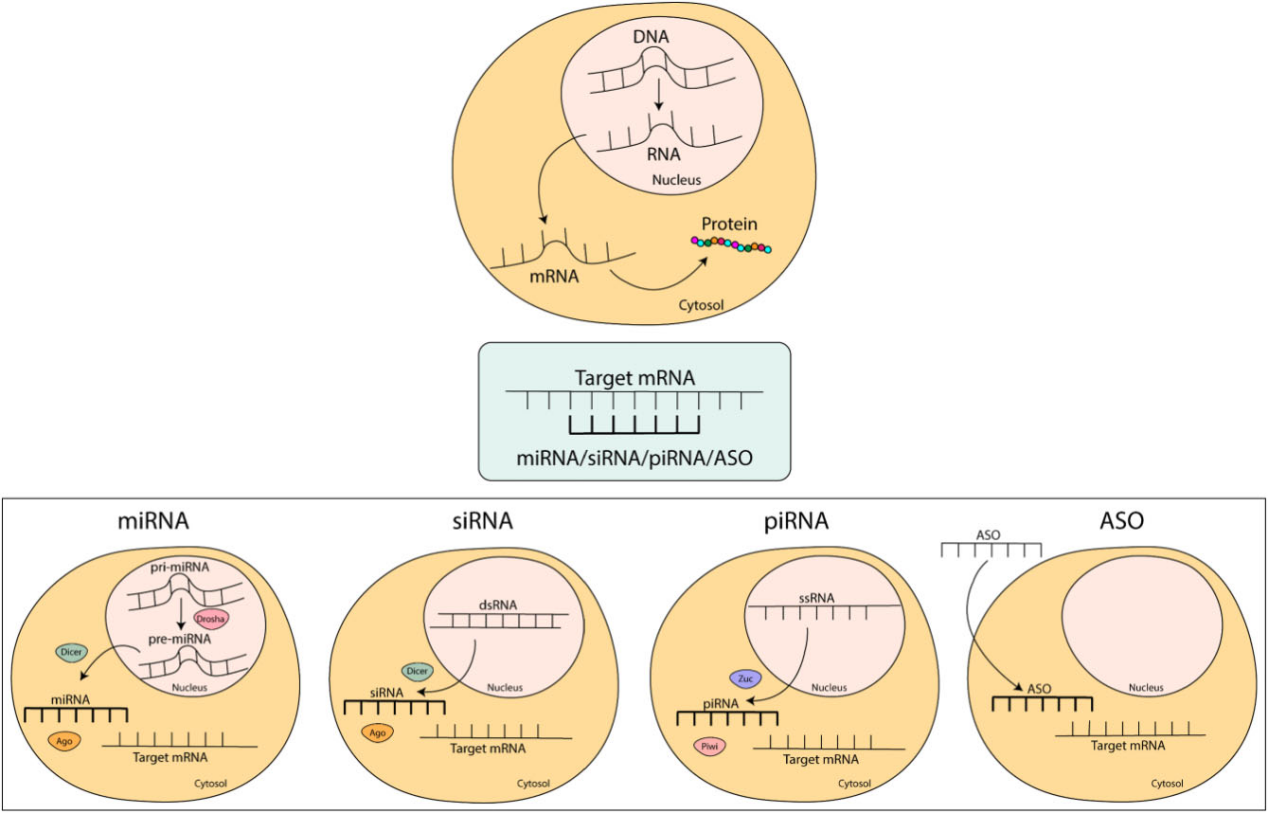
图1. 靶mRNA与小单链寡核苷酸之间的相互作用
miRNA、siRNA、piRNA和ASO是内源性和外源性的小单链寡核苷酸,在基因表达调控中起着至关重要的作用。它们能够与靶mRNA结合,并通过mRNA切割或抑制翻译诱导基因沉默。miRNA、siRNA和piRNA是RNA干扰途径的一部分,在细胞核中产生,然后经历不同的成熟步骤。相反,ASO是一种合成寡核苷酸,在细胞基因沉默中具有相同的作用。
二、RNA干扰的治疗策略
RNA疗法主要包括以下两类:(1)模拟内源性功能的miRNA/siRNA分子:这类合成分子通过化学修饰稳定结构,便于进入细胞与Ago蛋白结合,启动靶向mRNA沉默(图2A)。通过这种方式,不仅可以调控基因表达,还可以调节内源性miRNA或siRNA的丰度,而不会影响其生物合成途径。(2)反义寡核苷酸(ASO)(图2B):ASO为人工合成的单链寡核苷酸,长度12~30个碱基,能够与靶mRNA完全互补配对,诱导其降解或阻断其剪接和翻译过程。部分ASO还可靶向内源性miRNA或siRNA,阻断其作用,实现间接上调特定蛋白表达。
这些策略已在多种代谢性疾病、遗传性疾病及肾脏疾病中得到验证,部分药物已获得监管机构批准(表1)。
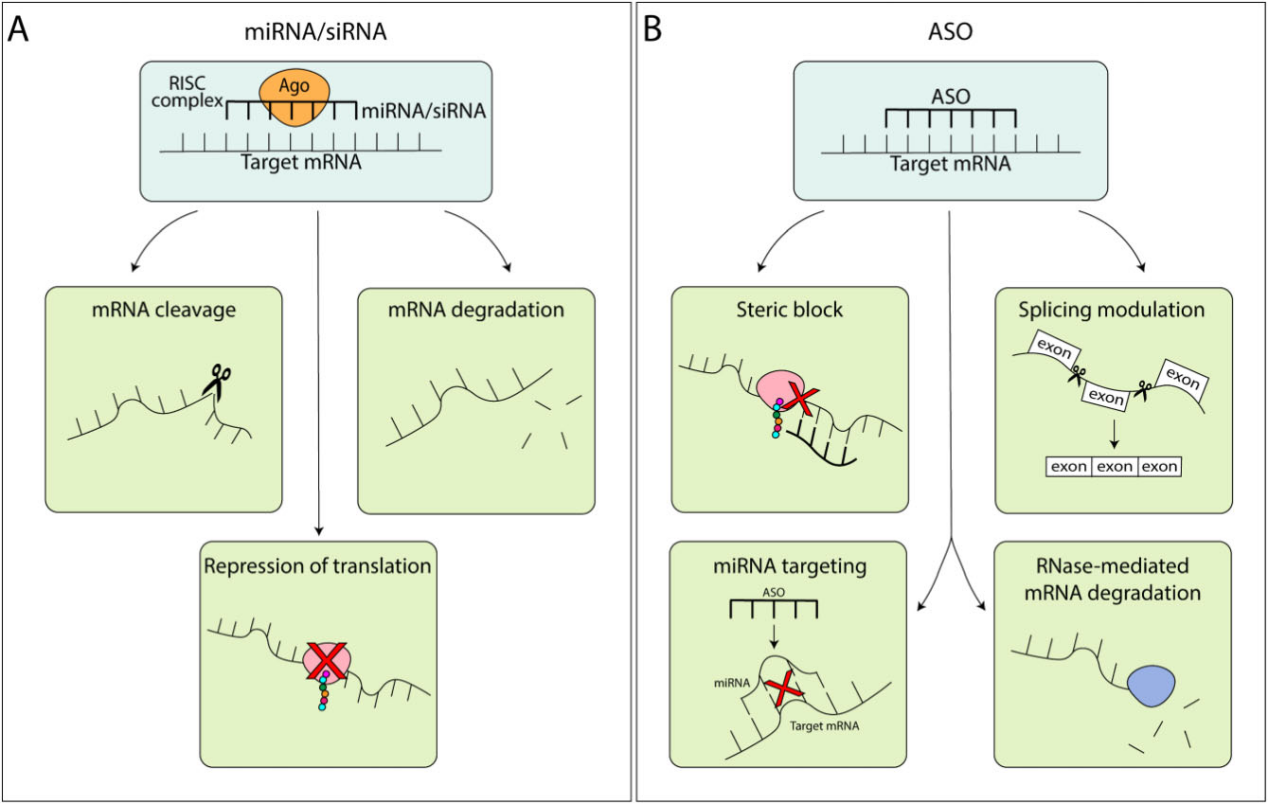
图2. miRNA、siRNA和ASO的作用机制。miRNA和siRNA被加载到Ago蛋白中,形成RISC复合体,这是一种效应复合体,能够通过mRNA切割、mRNA降解或翻译抑制来促进基因沉默(图A)。ASO能够直接结合靶mRNA,通过空间位阻、剪接调节、miRNA靶向或RNase介导的mRNA降解来诱导其沉默(图B)。
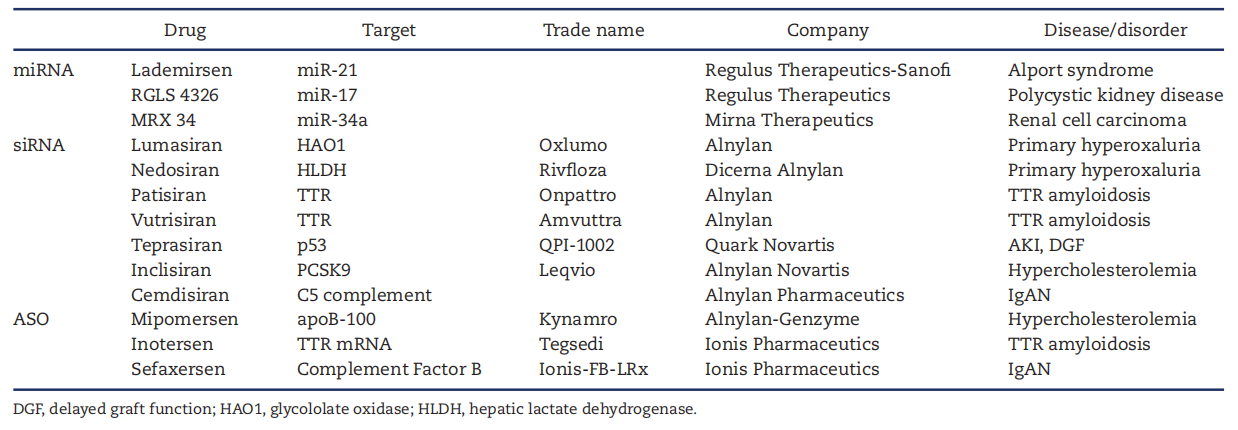
表1. 代谢紊乱及肾脏受累患者使用的mRNA阻断剂列表
1. miRNA疗法在肾脏疾病中的应用
(1)Alport综合征:抗miR-21药物Lademirsen
Lademirsen是一种修饰后的抗miR-21反义寡核苷酸,曾在两项临床试验中用于治疗Alport综合征。第一项研究是Ⅰ期研究(NCT03373786),结果尚未公布。第二项研究为2期临床试验,包括随机、双盲、安慰剂对照研究期和随后的开放标签期。尽管动物实验中表现出抗肾纤维化效果,但在人类研究中并未显著改善eGFR斜率或临床结局。由于研究样本量小、设计难度高,该药虽总体耐受性良好,但疗效有限,研究已终止。
(2)常染色体显性多囊肾病:抗miR-17药物RGLS4326
miR-17在ADPKD肾组织中高度表达,Regulus公司开发的RGLS4326在Ⅰ期b试验中表现良好,9例受试者经皮下注射后耐受性良好,部分患者的多囊蛋白水平出现下降,但仍需进一步验证其临床疗效。
(3)肾癌:miR-34a模拟物MRX34
MRX34为脂质纳米颗粒包裹的miR-34a模拟物,可抑制多种癌基因表达。Ⅰ期试验中,47例晚期实体瘤患者接受治疗,部分获得临床获益,安全性良好,但需要类激素预处理以减少输注反应。
2. siRNA疗法在肾脏疾病中的应用
(1)原发性高草酸尿症:Lumasiran与Nedosiran
Lumasiran(Oxlumo)与Nedosiran(Rivfloza)分别靶向肝脏的草酸代谢关键酶(GO与LDH),通过皮下注射显著降低尿草酸水平,延缓肾功能恶化,已获FDA与EMA批准用于PH1治疗。
(2)TTR淀粉样变性:Patisiran与Vutrisiran
Patisiran使用脂质纳米颗粒递送,抑制肝脏合成TTR蛋白;Vutrisiran采用GalNAc修饰递送系统,注射周期更长(每3月一次),在两项Ⅲ期试验(HELIOS-A、HELIOS-B)中均显示降低NT-proBNP及死亡风险的优效性,安全性良好。
(3)急性肾损伤:Teprasiran
Teprasiran靶向p53mRNA,用于预防心外科术后或肾移植后的AKI。Ⅱ期试验显示其可降低AKI发生率,减少透析需求,已进入进一步研究阶段。
(4)高胆固醇血症:Inclisiran
Inclisiran通过ESC-GalNAc平台靶向PCSK9,降低LDL-C水平超过50%,已在多个ORION研究中验证安全性,适用于有他汀不耐受或遗传性高胆固醇血症患者。目前尚无确凿证据表明其降低心血管事件风险。
3. ASO疗法在肾脏疾病中的应用
(1)Mipomersen:靶向apoB-100
该药用于治疗高胆固醇血症,尤其适用于无法耐受他汀的患者。尽管有效降低LDL-C,但其肝毒性限制了广泛应用,已从市场撤回。
(2)Inotersen:靶向TTRmRNA
适用于TTR淀粉样变性相关的多发性神经病患者,每周一次皮下注射,需密切监测肾功能与血小板。副作用包括肾小球肾炎与血小板减少,需警惕。
(3)APOL1ASO:用于FSGS
onis公司正开发APOL1靶向ASO药物,目前处于Ⅰ期与Ⅱ期临床阶段,旨在治疗具有APOL1高风险等位基因的非洲裔美国人群中常见的FSGS。
三、RNA疗法在IgA肾病等人类肾小球疾病中的探索
近年来,RNA疗法逐步应用于IgA肾病与补体介导性肾小球疾病。
1. Cemdisiran:靶向C5的siRNA
在IgA肾病Ⅱ期试验中,Cemdisiran显著降低24小时蛋白尿、C5与替代途径活性,治疗后77%的患者镜下血尿改善。尽管未能将蛋白尿降低至<0.5 g/d,但其疗效已显现。
2. SGB-9768:靶向C3的新型siRNA
尚处于早期研究阶段,初步数据显示其单次注射即可实现C3持续下降,未来有望用于C3肾小球病与IC-MPGN。
3. Sefaxersen(RO7434656):靶向CFB的ASO
在IgAN患者中试验显示,药物能降低CFB水平及蛋白尿,安全性良好。一项多中心Ⅲ期随机对照试验已启动,将进一步验证其疗效。
值得注意的是,补体系统在免疫防御中具有重要作用,长期抑制可能增加感染风险,治疗中应合理评估风险–收益比,并联用疫苗或抗菌预防策略。结语
RNA疗法正逐步成为肾脏病治疗的新前沿,尤其在罕见病、代谢病及肾小球疾病中展现出显著潜力。部分RNA药物已获得FDA/EMA批准,部分尚处于临床试验阶段,其靶向精准、机制明确、疗效持久的特点使其成为未来个体化治疗的重要工具。值得期待的是,这些疗法不仅在罕见病中应用广泛,未来亦有望拓展至高血压、糖尿病等更常见的慢性肾脏病病因中。
来源:Francesco Paolo Schena , Emanuela Pasculli. Clinical Kidney Journal, Volume 18, Issue 8, August 2025, sfaf214, https://doi.org/10.1093/ckj/sfaf214
- 推荐文章
