- 首页 > 正文
北大医院肾内科研究:中国COVID-19大流行后IgA肾病中新发微血管病变比例显著上升
发表时间:2026-02-04 09:10:47

一、研究背景与目的
IgA肾病(IgAN)以肾小球系膜区IgA沉积为特征,在亚洲人群中的发病率明显高于欧美人群。约90%以上的IgAN患者伴有C3沉积。微血管病变(MA)在IgAN中的检出率可达2%~53%,表现为小动脉血栓形成、内皮细胞肿胀、内膜水肿、纤维素样坏死及洋葱皮样病变等,其发生可能与补体系统的过度激活密切相关,并被认为是IgAN进展的重要独立危险因素。
2022年底,中国经历了COVID-19的广泛传播。既往已有报道提示COVID-19感染或疫苗接种可能诱发新发或复发IgAN及TMA(血栓性微血管病)。因此,本研究旨在评估COVID-19大流行前后,IgAN及其伴随MA病变的发病比例是否发生显著变化,并分析相关临床病理特征与潜在机制。
二、研究设计与方法
本研究为横断面分析,纳入2018年6月至2024年5月期间,在北京大学第一医院接受肾活检的22 123例患者,涵盖COVID-19疫情前、初期及广泛传播三个阶段。为建立可比较的基线作为对照,研究周期涵盖了这两个时间点前后各一年半。
研究按疫情发展划分如下:
阶段1(2018年6月至2019年11月):疫情前,无COVID-19感染;阶段2(2019年12月至2022年11月):部分感染期,同时疫苗开始接种;阶段3(2022年12月至2024年5月):全国广泛感染期。
为确保数据质量,排除其他肾病共病(如膜性肾病、糖尿病肾病等)、继发性IgAN、移植肾等共计526例。最终纳入5230例确诊IgAN患者,依据不同阶段开展统计分析,评估COVID-19大流行对IgAN患者总活检和MA病变中IgAN比例的影响,并对其中1417例患者(阶段1A、3A、3B)进行详细病理及免疫荧光特征比较。
三、主要研究结果
1. IgAN及MA病变比例持续上升
Cochran-Armitage趋势检验显示,随着疫情发展,IgAN在总活检中所占比例呈上升趋势(表1)(阶段1为22.6%,阶段3升至24.5%,P=0.01);同时,IgAN中伴MA病变的比例更是显著上升,从阶段1的3.6%跃升至阶段2的10.1%,直至阶段3的15.4%(P<0.001),呈现持续上升态势。
在进一步分期分析中,阶段3A和3B的MA病变比例分别为14.2%和16.5%,均显著高于疫情前的阶段1A(3.2%)(表2)。提示无论疫情期间还是疫情后,IgAN-MA病变比例均处于高位。
表1. 2018年6月至2024年5月期间,中国北方地区每半年新确诊IgAN与MA的变化趋势(引自发表的原文)
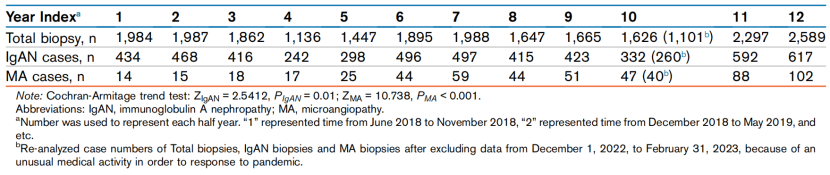
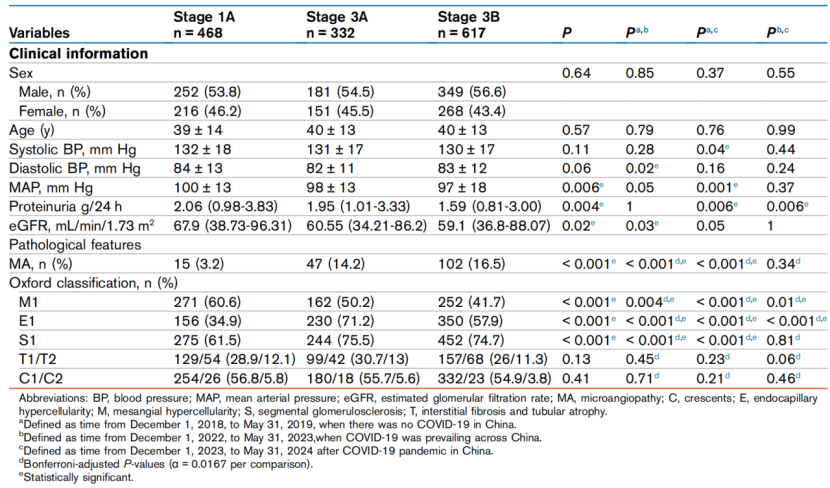
表2. COVID-19疫情期间及疫情前后各组的IgAN患者临床病理基线特征(引自发表的原文)
2. IgAN合并MA患者的临床特征
与疫情前相比,阶段3A患者的平均动脉压(MAP)更高,eGFR显著下降(中位数60.55 vs. 67.9 ml/(min·1.73m2),P=0.03),蛋白尿水平亦略有下降。Oxford分型显示,经历COVID-19流行的患者中,S1病变(节段性硬化)占比显著升高(约75% vs. 61.5%,P<0.001),而M1病变(系膜细胞增生)占比下降(表2)。
MA病变主要位于小动脉,仅少数合并肾小球内皮损伤。表现为内皮水肿/内膜水肿(82.3%)、小动脉血栓或纤维素样坏死(8.8%)、洋葱皮样病变(56.3%)。总体而言,3组患者在年龄、性别、平均动脉压、蛋白尿、eGFR及牛津MEST-C评分方面无显著差异。
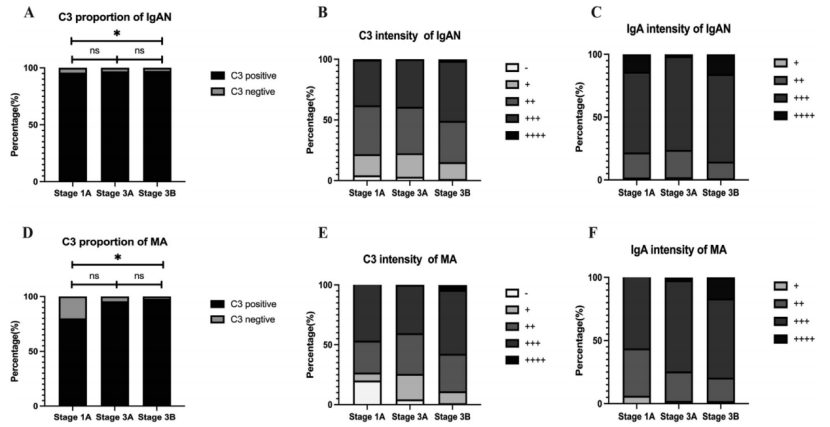
3. C3与IgA在肾组织中的沉积增强
免疫荧光分析显示,IgAN患者和MA患者的C3阳性比例随着时间的推移而逐渐增加,与1A阶段相比,3B阶段的C3沉积比例显著升高(IgAN患者中C3阳性率达98.7% [vs. 95.7%],P=0.01;MA患者中达98% [ vs. 80%],P=0.02),与补体系统的活化密切相关。
在IgAN患者中,C3沉积强度(≧++)在阶段3B显著高于阶段1A和阶段3A(阶段3B为506/597,84.8%;阶段1A为365/466,78.3%,P=0.007;阶段3A为251/324,77.5%,P=0.006)。IgA沉积强度(≧+++)亦在阶段3B更为显著(阶段3B为523/612,85.5%;阶段1A为364/466,78.1%,P=0.002;阶段3A为252/331,76.1%,P<0.001)(见图1B、1C)。
在所有三个阶段的MA患者中,C3沉积强度(≧++)和IgA沉积强度(≧+++)也呈逐步上升趋势,其中阶段3B的沉积最为明显,相较于阶段1A差异显著(见图1E、1F)。值得注意的是,在阶段3B期间,有4%(4/99)的患者被发现具有最强的C3沉积强度(++++),而这一现象在阶段1A中未见。此外,最强IgA沉积强度(++++)的患者比例在阶段3B也显著高于阶段1A和阶段3A(阶段1A为0%;阶段3A为1/47,2.1%;阶段3B为17/102,16.7%;P=0.02)(见图1)。
4. IgA肾病中微血管病变的危险因素分析
多因素logistic回归显示,以下因素与IgAN患者发生MA病变独立相关:
疫情暴露:与未感染COVID-19的阶段1A相比,阶段3A(可能存在COVID-19感染)的患者发生MA的风险显著升高,校正后的比值比(OR)为6.275(95%置信区间[CI]:3.021~13.034,P<0.001);阶段3B(既往感染)风险更高,OR为10.271(95%CI:5.236~20.144,P<0.001)。
平均动脉压(MAP):每升高1 mmHg,发生MA的风险增加约2.6%(OR=1.026,95%CI:1.011~1.041,P<0.001)。
eGFR:每升高1 ml/(min·1.73m²),MA风险下降约2.1%(OR=0.979,95%CI:0.969~0.989,P<0.001)。
S1病变:较S0,发生MA的风险为2.194倍(95%CI:1.183~4.072,P=0.01)。
T1病变(轻度小管萎缩/间质纤维化):相较于T0,风险增加为3.151倍(95%CI:1.729~5.543,P<0.001)。
T2病变(中重度纤维化):风险上升至8.728倍(95%CI:4.257~17.893,P<0.001)。
此外,性别、年龄、蛋白尿水平以及Oxford中的M、E评分在多因素分析中未显示显著相关性。
该结果表明,疫情因素(无论是感染还是疫苗接种后潜在免疫激活)、血压升高、肾功能下降以及病理中的S1和T病变是IgAN患者发展为MA病变的关键临床与组织学指标。提示应加强对高危患者的早期识别和干预。
四、讨论与启示
本研究显示,COVID-19大流行后,中国北方地区肾活检中IgA肾病(IgAN)的比例显著上升,且伴随微血管病变(MA)的发生率亦显著增加。尤其是在2022年底疫情大规模传播之后,IgAN中MA病变比例迅速上升。与此同时,后疫情阶段(阶段3B)的IgAN-MA患者,其肾组织中C3沉积水平明显高于疫情前与疫情期。补体系统激活可能在其中起关键作用。
补体系统过度激活被认为是COVID-19感染与IgAN-MA发生的共同核心环节。补体活化在COVID-19及其相关肾脏病变中的作用已被多项研究证实。Guo等人发现,COVID-19阳性IgAN患者血浆C5a、sC5b-9水平升高,肾组织中可见C4d、MAC及Gd-IgA1沉积增强。另有研究指出,IgAN患者疫苗接种后体内Gd-IgA1及SARS-CoV-2特异性IgA升高,提示分子模拟与免疫复合物沉积可能参与致病过程。
研究还提示,疫苗接种亦可能与IgAN发病相关。中国绝大多数人群接种的是灭活疫苗,虽反应温和,但仍有研究报告其后IgAN发病率上升。因此,IgAN患者疫苗接种后的监测仍需加强。
不过,本研究也存在局限,如:样本集中于中国北方;无法获取确切疫苗接种史与感染数据;病理诊断依据既往报告,未统一复评;缺乏长期随访数据等。
五、结论
COVID-19大流行后,中国IgAN患者中MA病变的比例显著上升,补体系统的激活可能是主要机制之一。无论是疫苗接种还是自然感染,均可能诱发或加重IgAN-MA病变。因此,未来应加强对IgAN患者补体活化状态的评估及长期随访,并探索靶向补体治疗的潜力。
来源:Kidney Med. 2025 Jun 3;7(8):101043. doi: 10.1016/j.xkme.2025.101043. eCollection 2025 Aug.
- 推荐文章
