- 首页 > 正文
IGNAZ临床研究首次证实Felzartamab靶向CD38阳性浆细胞具有治疗IgA肾病的潜在价值
发表时间:2026-02-03 11:26:06
Felzartamab(菲泽妥单抗)是一种全人源抗CD38单克隆抗体,可通过抗体依赖性细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP)清除CD38高表达的浆细胞和浆母细胞,从而抑制致病性抗体的产生。IGNAZ研究(NCT05065970)是首个评估felzartamab用于IgA肾病治疗的随机、双盲、安慰剂对照的IIa期临床试验,旨在评估其疗效与安全性。

IGNAZ研究分为两部分,共纳入54例经肾活检确诊为IgA肾病的成人患者,所有患者在接受最大耐受剂量RAS抑制剂治疗后仍存在持续性蛋白尿(≥1.0 g/d)。每部分都包括筛选期、6个月的治疗期和随访期(第一部分随访18个月,第二部分随访6个月)。
第一部分为随机、双盲、安慰剂对照试验,48例患者按1:1:1:1比例分配至安慰剂组(n=12)或三种felzartamab给药方案组:2剂(n=12,第1、15天各给药一次)、5剂(n=11,2个月内完成5剂给药)或9剂(n=13,5个月内完成9剂给药)。研究中Felzartamab的给药剂量依据患者体重确定,具体为:体重≤50 kg:650 mg,体重>50~70 kg:975 mg,体重>70~90 kg:1300 mg,体重>90 kg:1625 mg。
第二部分为开放标签研究,6例日本患者接受felzartamab 9剂方案治疗。完成后进入随访期。
felzartamab 首次输注速度为2 ml/min,若无输液反应(IRR),后续输注速度可提高至4 ml/min(第二次)或8 ml/min(后续输注)。每次输注前给予对乙酰氨基酚、苯海拉明、组胺H2受体拮抗剂、静脉注射甲泼尼龙预防输液反应。主要终点为治疗9个月时24小时尿蛋白/肌酐比值(UPCR)的变化。次要终点包括估算肾小球滤过率(eGFR)变化、不良事件发生率及严重程度。探索性终点包括血清Gd-IgA1、总IgA、IgG、IgM水平变化。
核心结果
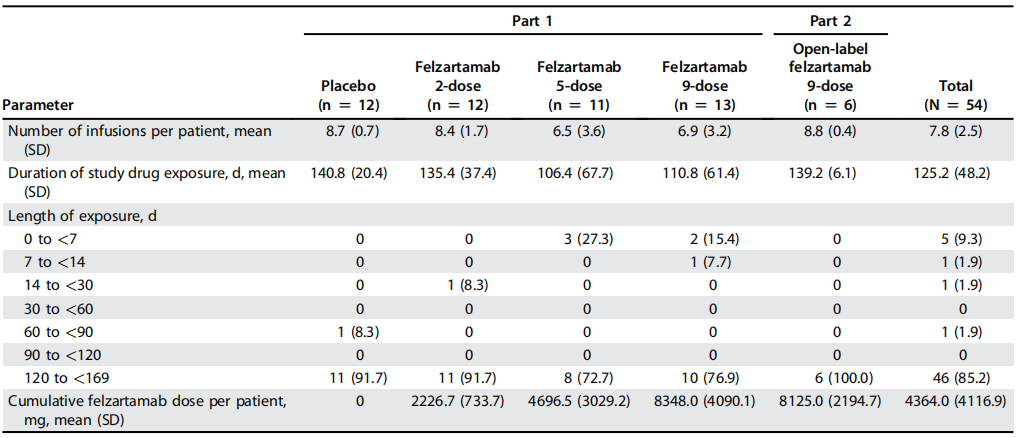
总体而言,54例患者中有46例(85.2%)完成6个月治疗期(第1部分,48例中的40例[83.3%];第2部分,6例[100.0%])。患者药物暴露量和依从性见表1。
1、蛋白尿的变化
在整个治疗期间及停药后随访中,观察到24小时UCPR降幅最大的是felzartamab 9次给药组。在9个月时(结束治疗后3个月,n=39),felzartamab治疗组患者的蛋白尿水平显著下降,与安慰剂组(UPCR下降5.7%)相比,felzartamab 2剂组下降12.5%,5剂组下降12.8%,9剂组下降29.5%。至24个月(即停药后18个月),felzartamab 2剂组UPCR较基线下降1.9%,5剂组下降9.5%,9剂组下降幅度进一步扩大至44.5%,而安慰剂组则出现轻微上升(增加3.7%)。日本患者在开放标签研究中亦表现出类似的蛋白尿下降(9个月下降44.8%,12个月下降48.8%),提示felzartamab在不同人群中均具有一致疗效(表1)。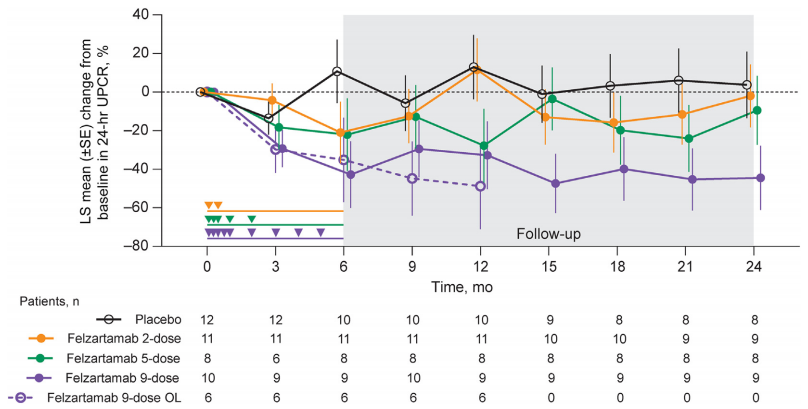
图1. 治疗期间UPCR的变化
2、肾功能的变化
在肾功能保护方面,felzartamab治疗组的eGFR下降幅度普遍小于安慰剂组。至24个月时(n=35),felzartamab 2剂组eGFR平均下降7.1 ml/(min·1.73m²)、5剂组下降4.0 ml/(min·1.73m2)、9剂组下降6.4 ml/(min·1.73m²),而安慰剂组下降达15.2 ml/(min·1.73m²),与安慰组的差异分别达8.1、11.2、8.8 ml/(min·1.73m²),提示felzartamab可能具有延缓肾功能恶化的潜力。在第2部分(n=6)中,12个月时平均eGFR相对于基线的变化为-9.6 ml/(min·1.73m²)(图2)。
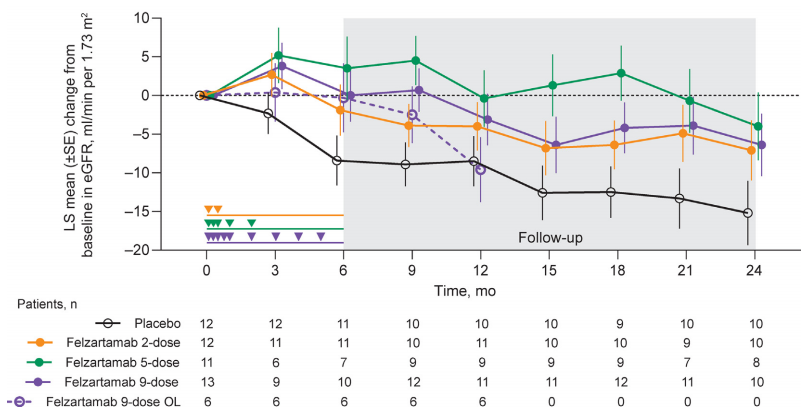
图2. 治疗期间eGFR的变化
3、免疫学指标变化
Felzartamab治疗后,患者血清总IgA水平显著下降,最大中位降幅为32.6%~35.8%,而安慰剂组仅为7.2%。其中,9剂组的IgA下降持续时间最长,至24个月仍有19.7%的降幅。相比之下,总IgG和IgM在治疗结束后6个月内迅速恢复至基线水平,提示felzartamab对不同类型的免疫球蛋白影响存在差异。
Gd-IgA1作为IgA肾病的关键致病因子,其水平在felzartamab治疗期间显著下降,最大降幅达31.2%~43.2%,但在停药后逐渐回升。尽管Gd-IgA1水平恢复,但蛋白尿的改善仍持续,提示除Gd-IgA1外,其他免疫机制可能亦参与蛋白尿的维持。
4、安全性评估
Felzartamab整体耐受性良好,不良反应以轻中度为主(1~2级),最常见的不良事件包括COVID-19、输液相关反应(IRR)、腹泻、鼻咽炎和上呼吸道感染。IRR是最常见的治疗相关不良事件,多发生于首次输注时,均为3级以下,经停药或对症处理后缓解。严重不良事件发生率较低(3.7%),未观察到与剂量相关的安全性问题。
感染事件发生率在felzartamab组略高于安慰剂组(40.4% vs. 33.3%),但均为轻中度,未出现严重感染。总IgG和IgM在停药后迅速恢复,提示felzartamab未造成长期免疫抑制。此外,研究未发现COVID-19疫苗接种后的免疫应答受损,进一步支持其良好的免疫安全性。
研究结论与展望
IGNAZ研究首次证实,靶向CD38阳性浆细胞的felzartamab治疗IgA肾病可显著、持续地降低蛋白尿,并可能延缓肾功能恶化,尤其在9剂给药方案中疗效最为显著。其机制可能与清除产生Gd-IgA1及其自身抗体的浆细胞有关。尽管Gd-IgA1在停药后恢复,但蛋白尿改善持续,提示felzartamab可能通过多重机制发挥疾病修饰作用。
该研究为IgA肾病治疗提供了新的方向,即通过靶向致病抗体产生的上游细胞——CD38阳性浆细胞,干预疾病根本机制。尽管样本量较小,且为Ⅱ期研究,但结果极具前景,目前 其Ⅲ期临床试验正在进行中。
随着对IgA肾病免疫机制认识的不断深入,未来治疗策略可能趋向多靶点联合,如将B细胞/浆细胞调节剂与肾内炎症抑制剂联合应用,以实现更全面、持久的疾病控制。Felzartamab作为首个抗CD38单抗在IgA肾病中的成功探索,标志着精准免疫治疗在该领域迈出了重要一步。
参考文献:Jürgen Floege, etal. Kidney Int . 2025 Jun 26:S0085-2538(25)00488-0. doi: 10.1016/j.kint.2025.05.028. Online ahead of print.
- 推荐文章
