- 首页 > 正文
肾域华章 | 上海曙光医院课题组揭示中药复方仙黄方抗肾间质纤维化的分子机制!
发表时间:2026-02-04 13:19:28
编者按
中药复方仙黄方(Xian Huang Fang, XHF)在临床上常用于慢性肾脏病(CKD)的治疗,具有保护肾功能、延缓疾病进展的作用。然而,其抗肾间质纤维化(RIF)的具体分子机制尚不明确。上海中医药大学附属曙光医院课题组对此进行了探索,研究发现,XHF通过抑制PKCδ/MAPK信号通路,减轻肾小管上皮细胞衰老,从而延缓肾间质纤维化。该研究近期已在线发表于Drug Des Devel Ther.。

研究背景
慢性肾脏病(CKD)是全球非传染性疾病发病率和死亡率上升的重要因素之一。肾间质纤维化(RIF)是多种CKD进展的共同病理途径和主要表现。肾小管上皮细胞(RTECs)作为肾小管间质的主要细胞成分,在损伤后修复能力下降,表现为细胞周期停滞、部分上皮-间质转化(EMT)以及病理性细胞衰老。缺氧、代谢应激和持续性损伤等因素均可诱导RTECs进入衰老状态。目前尚缺乏有效阻止肾小管损伤和纤维化的治疗策略,因此亟待开发靶向病理性细胞衰老等关键驱动因素的新型治疗策略。
细胞衰老不仅是衰老的结果,更是推动CKD进展中纤维化的重要驱动因素。衰老细胞通过分泌衰老相关分泌表型(SASP)因子,如IL-6、TGF-β1等,形成有害微环境,促进炎症反应、成纤维细胞活化和细胞外基质(ECM)沉积,从而加速RIF进展。MAPK家族成员(p38、ERK、JNK)等上游激酶可调控SASP活性,因此靶向调控病理性衰老的信号通路有望中断CKD中炎症与纤维化的恶性循环。
仙黄方(XHF)由大黄(Rheum palmatum)和淫羊藿(Epimedium)组成,是中医药用于治疗CKD的临床常用配伍。其生物活性成分淫羊藿苷(来自淫羊藿)和大黄素(来自掌叶大黄),已被证实具有抗炎、抗氧化和抗纤维化特性。上海中医药大学附属曙光医院研究团队的前期探索发现,淫羊藿苷可通过抑制成纤维细胞活化减轻肾纤维化,大黄素则通过抑制EZH2改善梗阻性肾病中的肾小管间质纤维化。然而,XHF是否通过调控细胞衰老这一关键病理过程来抗纤维化,其分子机制尚不明确。
因此,上海中医药大学附属曙光医院课题组开展研究,探讨了XHF是否通过靶向病理性细胞衰老缓解肾间质纤维化。他们结合网络药理学预测PKCδ为核心靶点,并在体内外模型中验证其作用,进一步阐明XHF抗纤维化与抗衰老之间的分子联系。
研究方法
研采用超高效液相色谱-四极杆-轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)对复溶的XHF冻干粉进行化学成分分析。通过5/6肾切除(A/I)建立慢性肾衰竭模型,使用5 ng/ml转化生长因子β1(TGF-β1)诱导人肾小管上皮细胞(HK-2)纤维化。采用网络药理学、组织病理学、蛋白质印迹法、免疫荧光(IF)及衰老相关β-半乳糖苷酶(SA-β-gal)染色等方法评估其作用机制。
研究结果
1.XHF化学成分分析
XHF由15 g掌叶大黄和15 g淫羊藿组成。将煎剂混合物冷冻干燥成标准粉末。采用UHPLC-Q-Orbitrap HRMS进行化学分析(图1),鉴定出XHF中6种特征成分:芦荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚和淫羊藿苷。
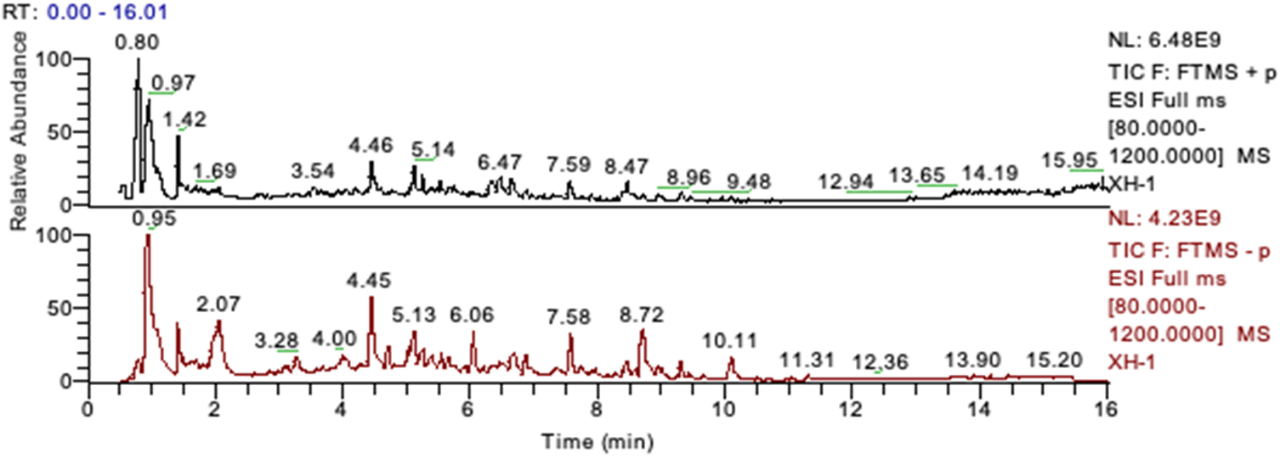
图1. XHF的UHPLC-Q-Orbitrap HRMS分析
2.XHF改善5/6(A/I)肾切除诱导的肾纤维化进展
通过5/6肾切除(A/I)建立大鼠CKD模型,随后用不同剂量的XHF和氯沙坦(LOS)处理大鼠8周。结果显示,XHF治疗显著降低模型大鼠血清Scr、UACR、IL-6和TNF-α水平(图2A–D)。组织染色显示XHF治疗显著减轻肾小管损伤、炎症浸润和胶原纤维沉积(图2E)。Westernblot分析结果显示XHF下调纤维化标志物纤维连接蛋白(FN)、vimentin、α-SMA表达(图2F–I),并显著恢复钠钾ATP酶β1亚基(ATP1B1)和水通道蛋白1(AQP1)的表达(图2L和M),提示其改善肾小管功能。
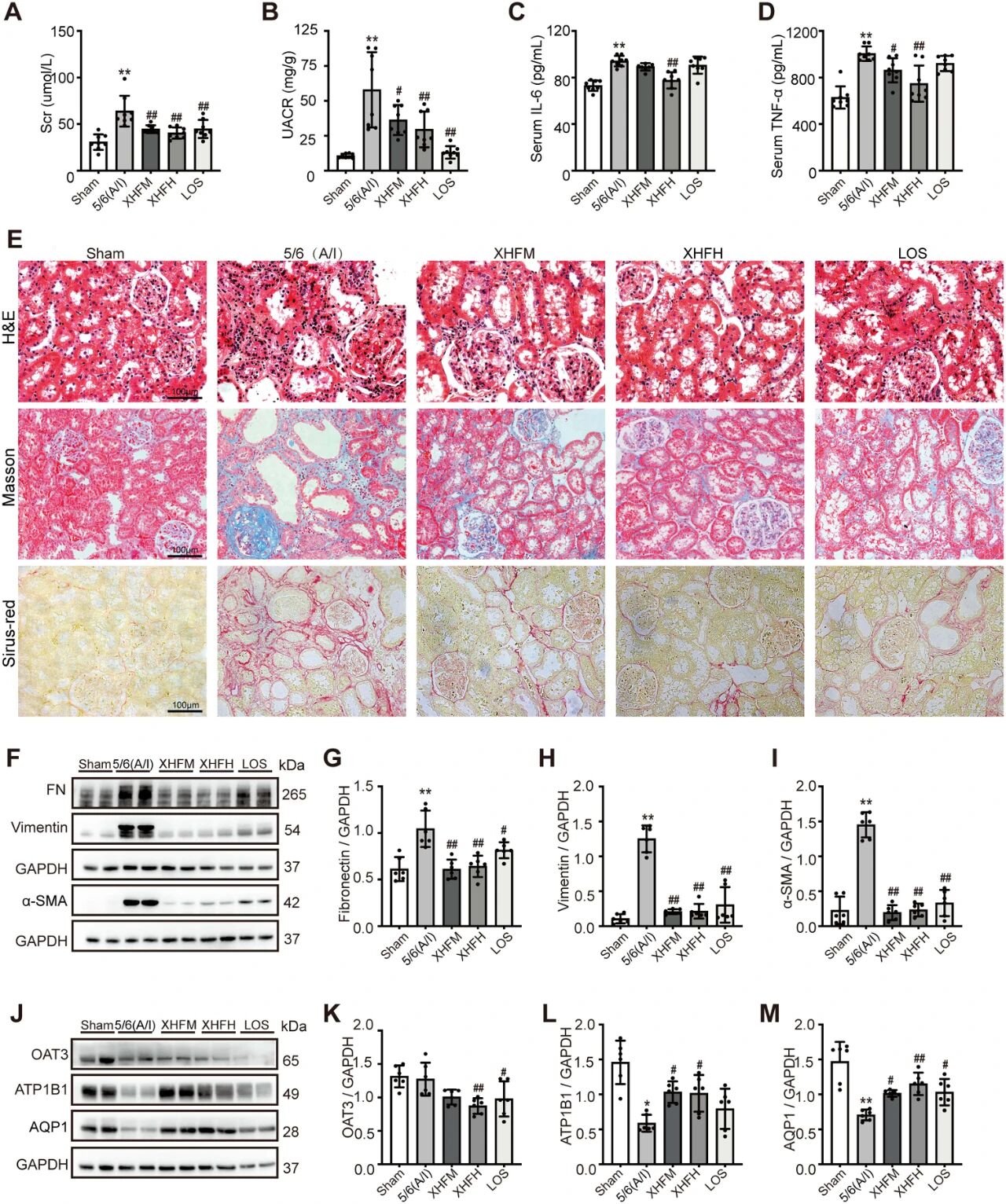
图2. XHF改善5/6(A/I)肾切除诱导的CKD大鼠的肾纤维化并调节水通道蛋白表达。*P<0.05,**P<0.01,与假手术组相比;#P<0.05,##P<0.01,与5/6(A/I)组相比。假手术组:假手术组;5/6(A/I):模型组。
3.网络药理学分析提示PKCδ为核心靶点
共筛选出119个XHF与CKD共同靶点,基于这些靶点构建的蛋白质-蛋白质相互作用(PPI)网络分析显示,蛋白激酶Cδ(PKCδ)为核心靶点(图3A–B)。KEGG富集分析提示AGE-RAGE、MAPK等通路可能参与XHF作用(图3C–D)。换言之,XHF主要通过PKCδ信号通路,同时抑制纤维化相关通路,来改善肾纤维化和延缓慢性肾脏病进展。
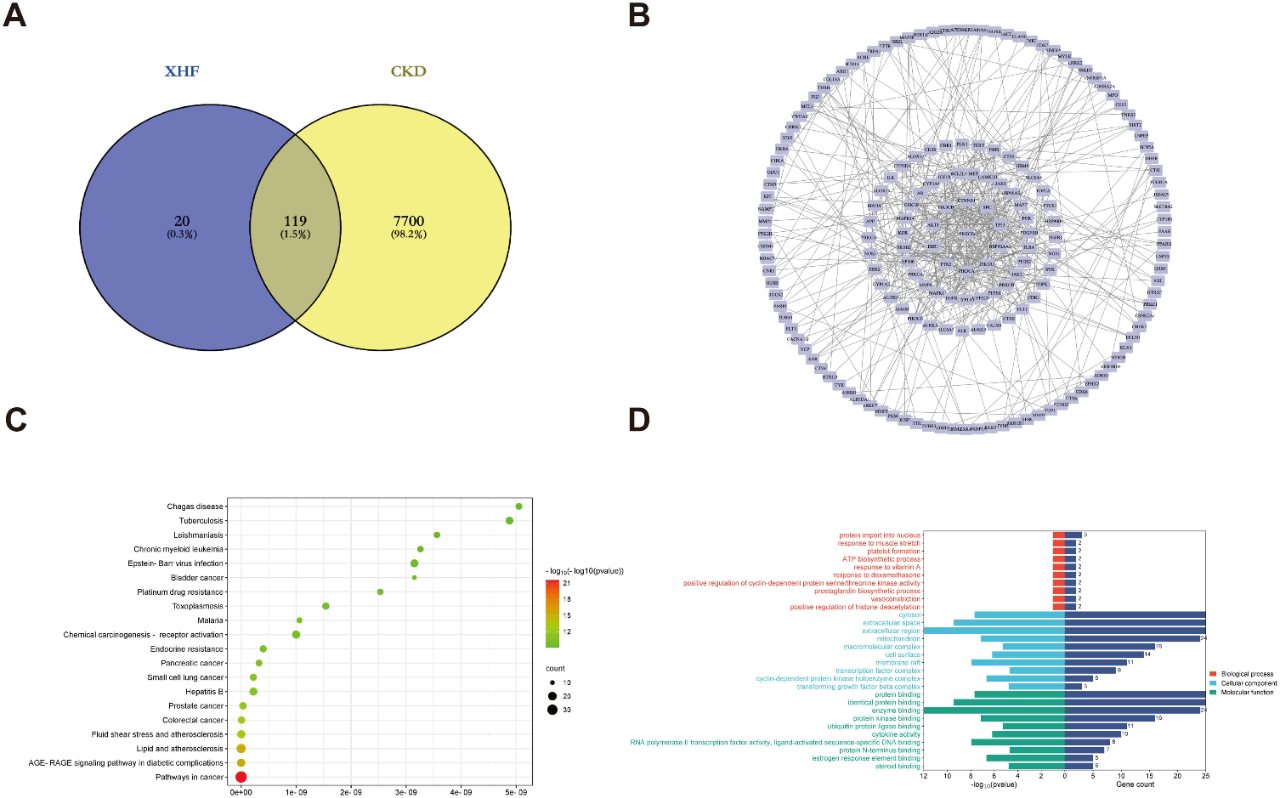
图3. XHF在慢性肾脏病中的共同靶点和功能富集分析。(A)共鉴定出119个XHF和慢性肾脏病之间的重叠蛋白靶点。(B)蛋白质-蛋白质相互作用网络。(C)前20个KEGG的富集结果。(D)基因本体论术语富集。顶级生物学过程(BP,上部);顶级细胞组分(CC,中部);顶级分子功能(MF,下部)。
4.XHF通过抑制PKCδ/MAPK信号通路改善肾纤维化
研究人员进一步探索了XHF是否能减轻HK-2损伤及TGF-β1诱导的纤维化表型。结果发现,在TGF-β1诱导的HK-2细胞中,XHF和PKCδ抑制剂Rottlerin(1μM)均能有效改善以增殖抑制和纤维化为特征的双重表型(图4C–H)。
在该模型中的实验验证(基于蛋白质-蛋白质相互作用网络分析)确定PKCδ/MAPK是XHF调控的更重要靶点。结果表明,XHF和Rottlerin均能有效抑制TGF-β1诱导的PKCδ酪氨酸311(Tyr311)磷酸化位点的激活,并显著抑制c-Jun氨基末端激酶(JNK)、细胞外调节蛋白激酶(ERK)和p38丝裂原活化蛋白激酶的磷酸化水平(图4I–M)。在5/6(A/I)肾切除模型大鼠肾组织中也观察到类似结果(图5A–E)。总体而言,这些数据表明,XHF主要通过抑制PKCδ磷酸化和随后的MAPK通路抑制来减轻肾纤维化。
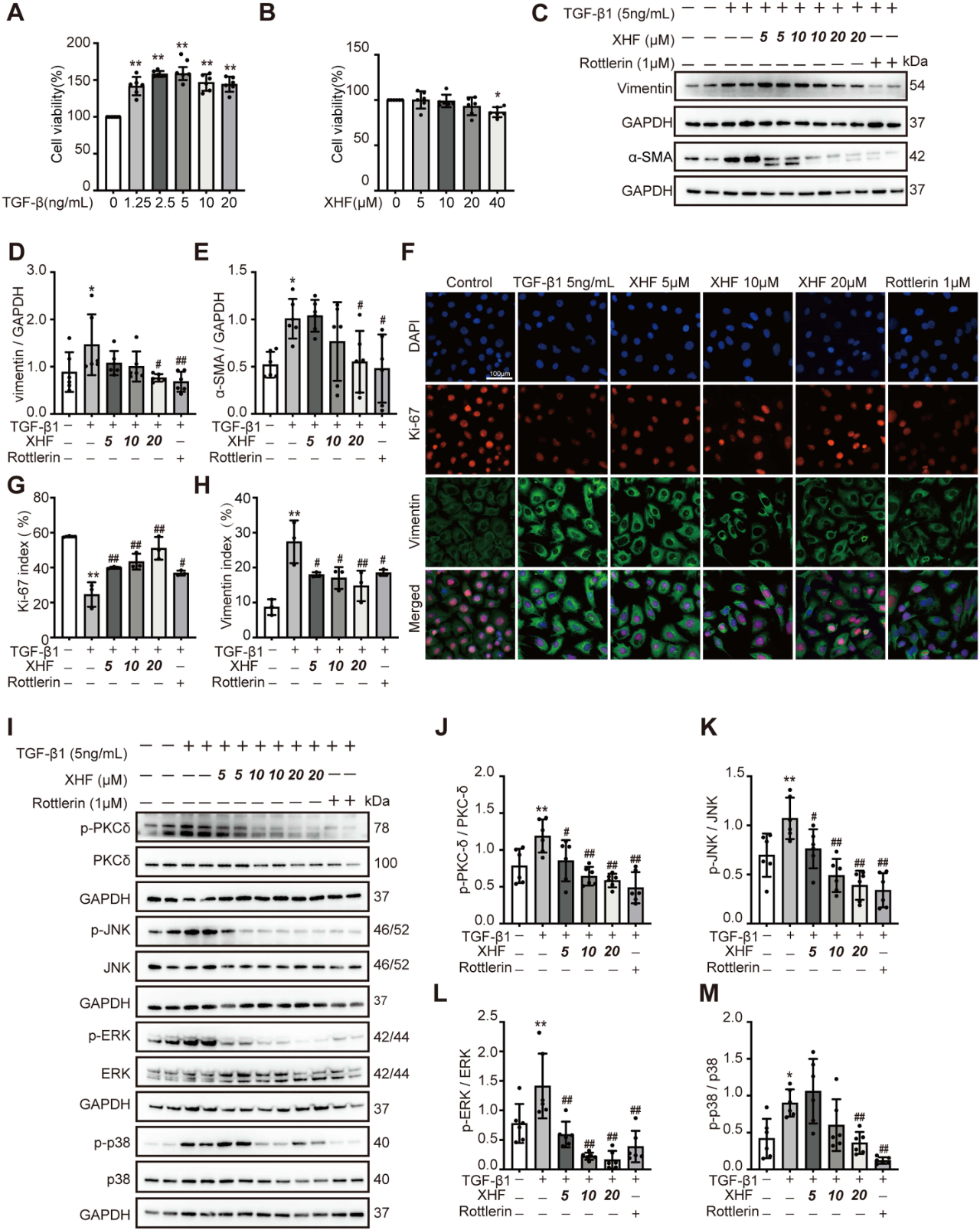
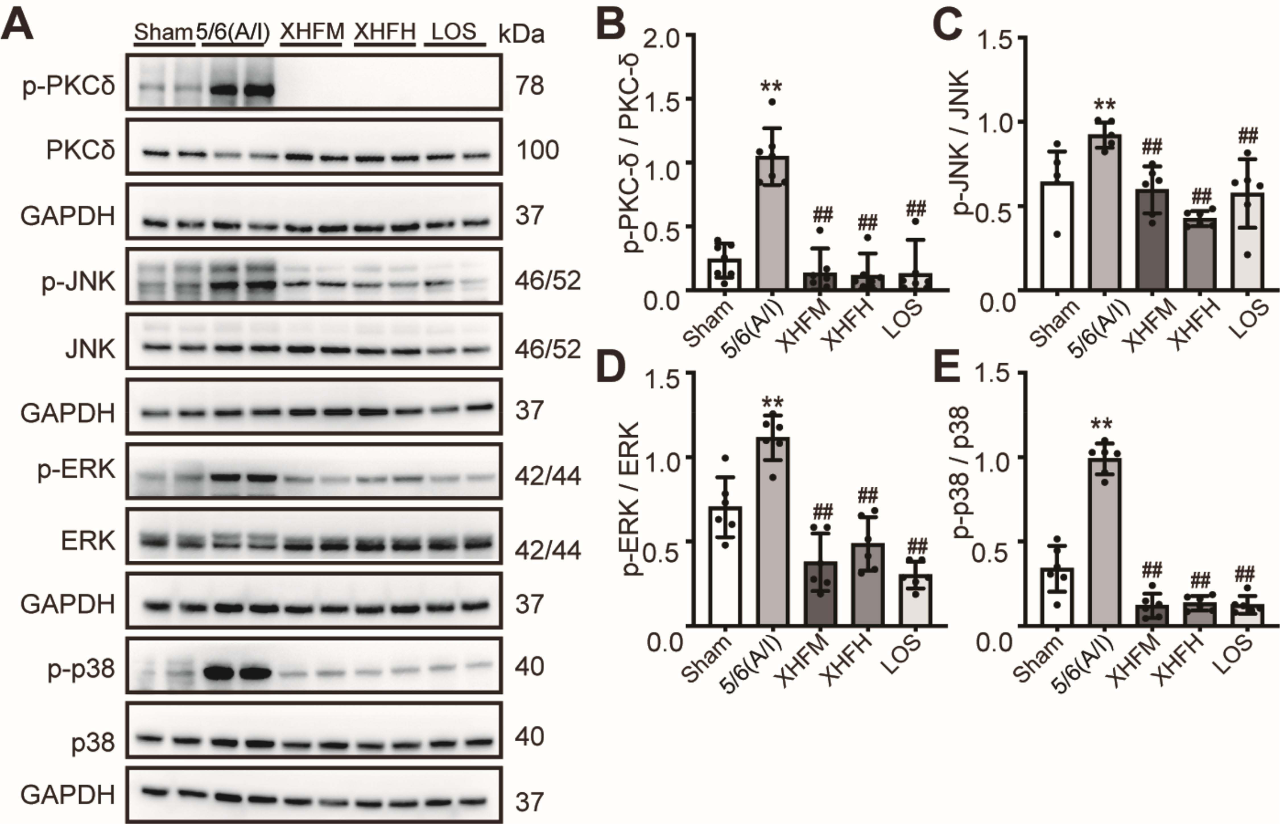
图5. XHF减弱5/6(A/I)肾切除诱导的慢性肾脏病大鼠肾组织中PKCδ激活和下游信号通路。(**P<0.01,与假手术组相比;##P<0.01,与5/6(A/I)组相比。)
5.XHF通过抑制5/6(A/I)大鼠的内质网应激与细胞衰老来改善肾纤维化
在5/6肾切除大鼠中,XHF显著降低内质网应激相关蛋白免疫球蛋白重链结合蛋白(BIP)和C/EBP同源蛋白(CHOP)、p53、p21、磷酸化核因子-κB(p-NF-κB)以及IL-6表达,减少肾组织中SA-β-gal阳性细胞数(图6A–J)。在HK-2细胞中,XHF和Rottlerin均能抑制TGF-β1诱导的BIP、CHOP、p21、p-NF-κB和IL-6表达,并减少SA-β-gal阳性细胞(图7A–I)。XHF 20μM和rottlerin的联合用药显示了二者可协同抑制p-PKCδ、p-NF-κB和IL-6的作用(图7J–M)。
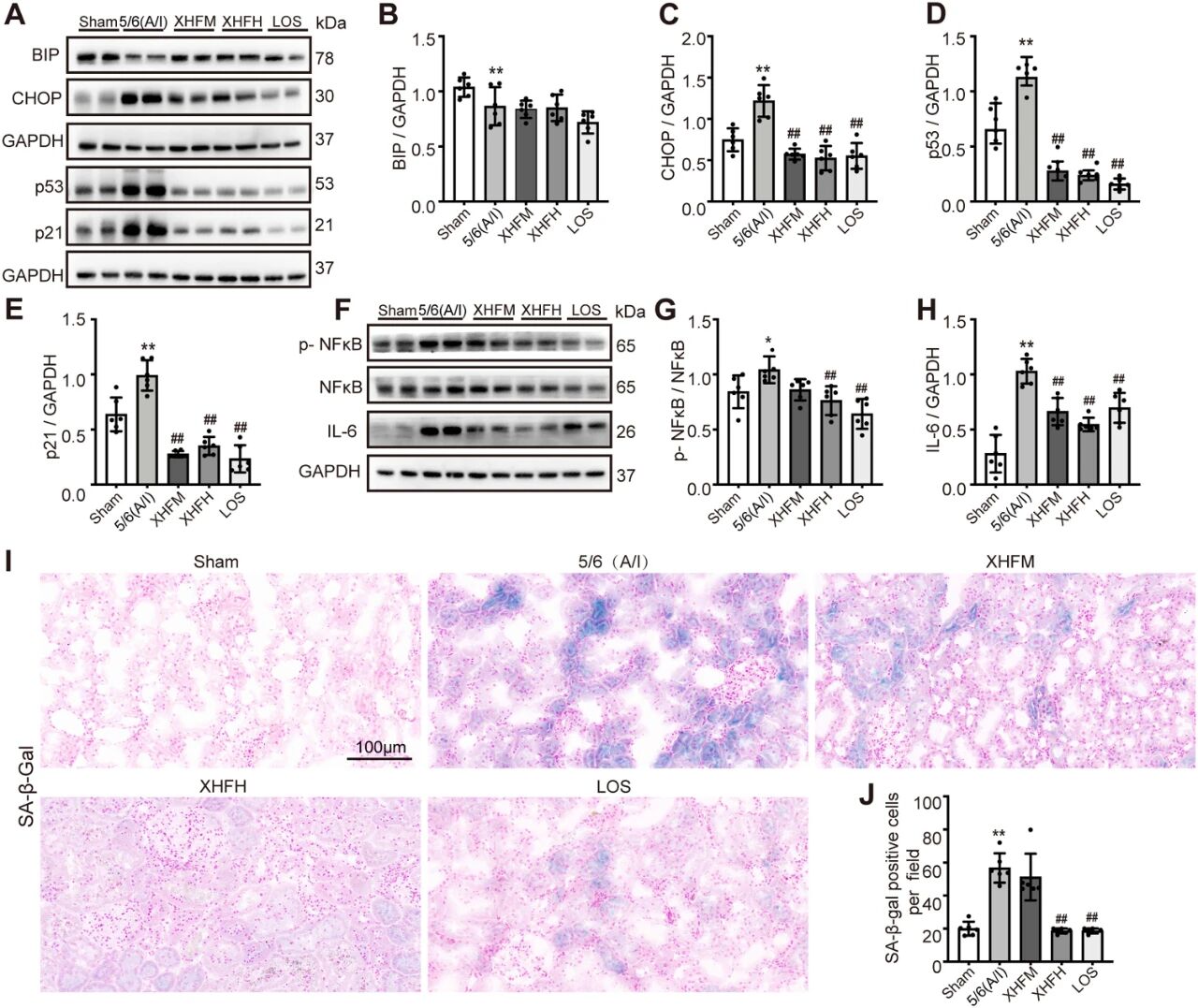
图6. XHF减轻5/6(A/I)肾切除诱导的慢性肾脏病大鼠肾组织中的内质网应激、细胞衰老和衰老相关分泌表型相关炎症(*P<0.05,**P<0.01,与假手术组相比;##P<0.01,与5/6(A/I)组相比)
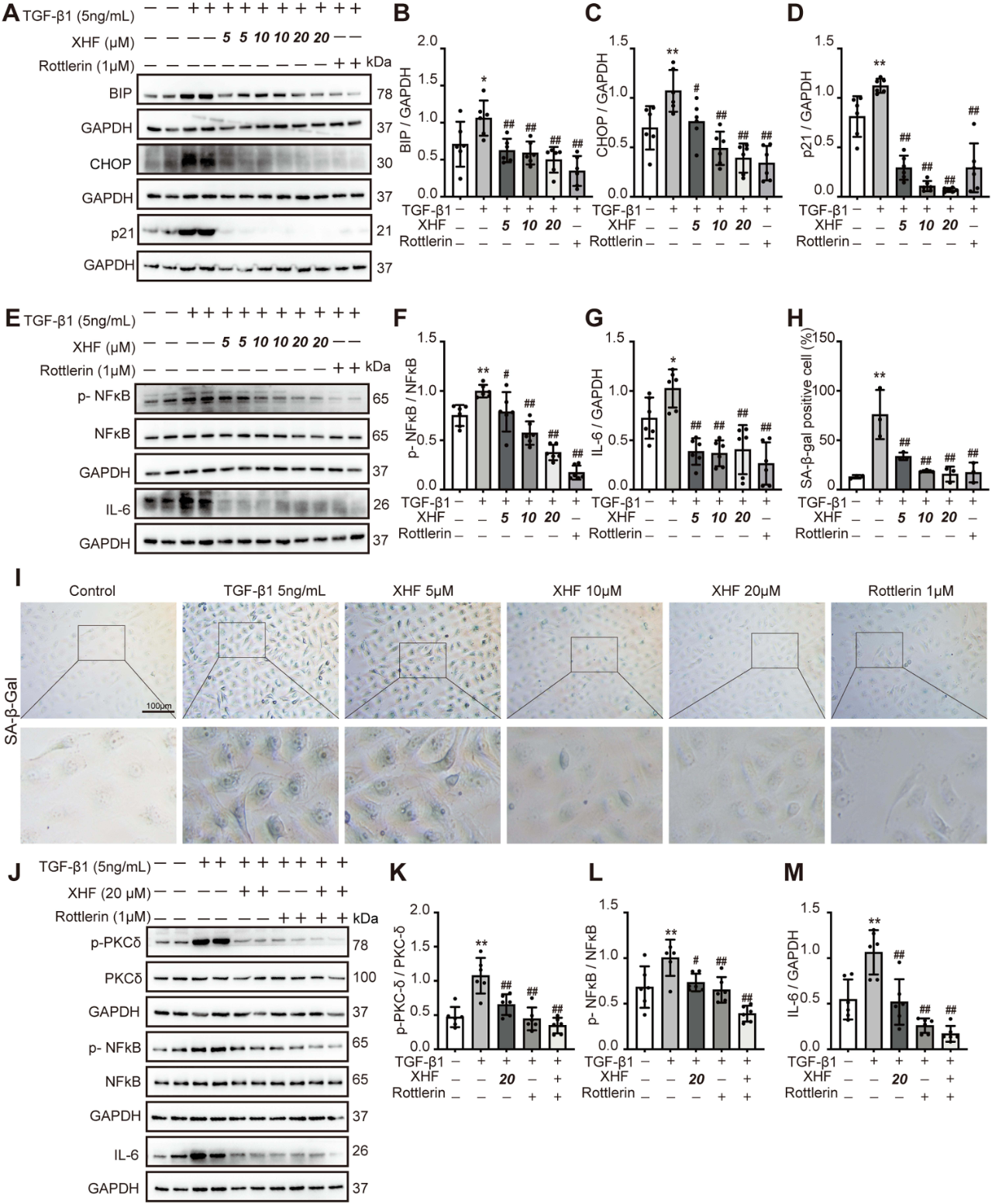
图7. XHF减轻转化生长因子-β1诱导的人近端肾小管上皮细胞内质网应激和细胞衰老
讨论
本研究通过整合网络药理学与实验验证,确定了PKCδ是XHF的关键潜在靶点,首次揭示XHF通过抑制PKCδ/MAPK信号通路减轻肾小管上皮细胞衰老,从而延缓肾间质纤维化的机制。研究人员在5/6肾切除大鼠和TGF-β1诱导的HK-2细胞模型中均观察到XHF显著抑制PKCδ磷酸化,进而下调MAPK信号通路(JNK、ERK、p38)和NF-κB活化,减少IL-6等关键衰老相关分泌表型(SASP)因子分泌,最终缓解细胞衰老和纤维化表型。
细胞衰老在CKD进展中扮演关键角色。衰老细胞通过p53/p21通路停滞细胞周期,分泌IL-6、TGF-β1等因子,促进炎症和ECM沉积,形成纤维化微环境。PKCδ作为上游激酶,在CKD患者和动物模型中表达上调,其激活可促进线粒体功能障碍、细胞凋亡和SASP分泌。本研究证实XHF通过抑制PKCδ磷酸化,阻断其下游MAPK/NF-κB/IL-6信号轴,从而干预衰老-纤维化恶性循环。
尽管网络药理学提示AGE-RAGE通路可能参与XHF作用,但实验验证更支持PKCδ/MAPK通路的主导地位。Rottlerin的药理学验证进一步支持PKCδ的核心作用,但其脱靶效应仍需通过基因敲减等遗传学手段进一步验证。
结论
本研究表明,PKCδ是XHF的关键潜在靶点,其通过抑制PKCδ/MAPK信号通路,减轻内质网应激与肾小管上皮细胞衰老,显著改善肾间质纤维化和减轻肾功能损伤。其作用机制涉及降低SASP因子分泌、抑制炎症反应及恢复肾小管功能。作为一种传统中药复方,XHF展现出良好的应用前景,有望成为CKD抗纤维化治疗的潜在候选方案。未来仍需开展临床验证及基因水平研究,以进一步阐明其分子作用网络及长期疗效。
来源:Drug Des Devel Ther. 2025 Aug 13:19:6991-7004. doi: 10.2147/DDDT.S522318. eCollection 2025.
- 推荐文章
