- 首页 > 正文
房中则教授:肠道菌群——代谢性疾病防治的新靶点与新策略
发表时间:2026-02-04 14:45:01
在第四届中国肥胖大会(COC 2025)上,天津医科大学公共卫生学院房中则教授分享了其团队在肠道菌群与代谢性疾病领域的突破性研究进展,并基于此提出了创新性的理论见解与干预策略,为破解代谢性疾病防治难题提供了全新视角!

天津医科大学教授,博士生导师
天津医科大学公共卫生学院副院长
国家预防医学实验教学中心常务副主任
卫生毒理与卫生检验检疫系主任
天津医科大学总医院儿科科研副主任(兼职)
主要研究方向为“代谢毒理学”、“代谢流行病学”以及“代谢物监测的可穿戴生物传感器的开发及医学应用”。
天津市千人计划专家,天津市特聘教授,天津市创新推动领军人才,天津市高校中青年骨干创新人才,天津市131人才,天津医科大学卓越人才PI。
中国生物物理学会肠道菌群分会副秘书长、中国环境诱变剂学会理事、中国毒理学会青年理事会常务理事、天津预防医学会毒理学分会主任委员
近年来获得国家科技部精准医疗重大专项、国家科技部“发育编程及其代谢调节”专项、“生物大分子与微生物组”专项和大气专项、国家卫健委肝病和传染病重大专项、国家自然科学基金重大研发计划项目及面上项目、天津市组织部人才项目基金、天津市科委面上基金、天津市卫计委专项基金等多项基金的资助。
近年来深耕于电化学柔传感器、自供能传感器等可穿戴设备用于医疗以及健康监测当中。作为牵头人和共同发起人建立了天津妊娠糖尿病队列、天津儿童青少年生长发育队列、吉林梅河口自然人群队列等多个人群队列。
在Lancet Public Health, The Lancet Diabetes & Endocrinology, Ebiomedicine, Nano Energy, Chemical Engineering Journal, Metabolism, Science of The Total Environment, Chemosphere, Environmental Pollution, The American Journal of Clinical Nutrition, The Journal of Clinical Endocrinology & Metabolism等.等国际相关领域权威学术刊物上发表SCI论文150余篇,发表论文总引用5000余次。
人卫出版社预防医学专业《毒理学基础》(第八版)编委、科学出版社“十四五”研究生规划教材《队列研究:理论与实践》、《毒理学原理与方法》编委。多次为Science等国内外知名杂志作述评专家,获得省部级奖项两项。
研究背景:代谢性疾病的严峻挑战与“第二基因组”的希望
代谢性疾病(如肥胖、2型糖尿病、脂肪性肝病、心血管疾病)已成为全球性的重大公共卫生负担,其防治形势在我国同样极为严峻。为此,我国针对代谢性疾病发起“攻坚战”。《“健康中国2030”规划纲要》明确指出:至2030年需将重大慢性病过早死亡率降低30%。
然而,当前的治疗策略存在明显瓶颈。患者往往多病伴发,需同时服用多种药物,不仅增加了副作用风险和医疗负担,且多数药物仅能控制症状,难以根治。深究其因,在于这些疾病背后存在着复杂的器官互作和共同的病理生理机制,而现有药物多为单靶点干预,难以应对系统性代谢失衡。因此,寻找能够整合多器官信号、调控系统代谢稳态的“中枢”靶点,是突破当前困境的关键。
近年来,肠道菌群研究的蓬勃兴起为我们带来了全新的视角。肠道菌群所拥有的基因数量远超人类自身,故而被称作“第二基因组”。它不仅参与营养物质的消化与吸收,还能产生大量具有生物活性的代谢物,如短链脂肪酸(SCFAs)、次级胆汁酸等。这些物质可进入血液循环,作用于远端器官,调控宿主的免疫、神经及代谢过程。肠道菌群因此被视作“新型内分泌器官”(图1),既能介导器官间的相互作用,也成为代谢性疾病的重要干预靶点。
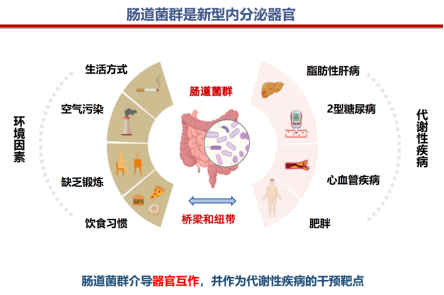
图1. 肠道菌群:连接环境因素与代谢疾病的桥梁
新理论:代谢性疾病肠治[1]
该理论指出,肠道作为代谢调控的“上游”器官,通过对肠道内信号通路进行干预,能够系统性地改善下游多个代谢器官的功能。团队以动脉粥样硬化这一典型心血管代谢疾病为例,深入探究了“肠-血管”对话的具体机制。研究发现,法尼醇X受体(FXR)是肠道中一个至关重要的受体,能够感知胆汁酸等代谢物的变化。在动脉粥样硬化模型小鼠中,特异性敲除肠道FXR可显著减轻主动脉粥样硬化斑块的形成。这种保护作用的背后,是一种名为神经酰胺的脂质分子发生了改变:肠道FXR被敲除后,小鼠肠道及血液中的神经酰胺水平均显著降低(图2)。
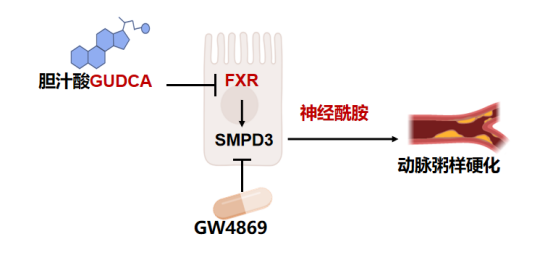
图2. 胆汁酸GUDCA-肠FXR-神经酰胺轴介导肠-血管互作
进一步研究表明,神经酰胺合成酶SMPD3(鞘磷脂磷酸二酯酶3)是肠道FXR的直接靶基因。FXR被激活时,会促进SMPD3的表达,进而增加神经酰胺的合成。若在肠道FXR敲除小鼠中过表达SMPD3,其对动脉粥样硬化的保护作用将会消失。这明确揭示出一条信号通路:肠道FXR激活→SMPD3上调→神经酰胺合成增加→动脉粥样硬化加重。
更具意义的是,研究团队发现,一种由肠道菌群代谢产生的胆汁酸——甘氨熊脱氧胆酸(GUDCA),可作为肠道FXR的拮抗剂。给动脉粥样硬化模型小鼠补充GUDCA,能有效抑制肠道FXR信号通路,降低神经酰胺水平,从而缓解动脉粥样硬化症状。这一发现不仅证实了“肠-血管”互作轴的存在,也为“肠治”策略提供了具体的分子靶点和潜在的干预物质。
新范式:宿主反向调控菌群代谢[2]
肠道菌群不仅会对宿主产生影响,宿主基因也能够反向调控肠道菌群的组成与功能,进而影响全身代谢。这一新范式为理解宿主与微生物共生的复杂关系开创了新的维度。研究发现,肠缺氧诱导因子-2α(HIF-2α)敲除会使肠道菌群的组成发生改变,而宿主肠HIF-2α调控菌群稳态的关键介质是乳酸——HIF-2α通过调节Ldha(乳酸脱氢酶)的表达调控肠道乳酸水平(图3)。
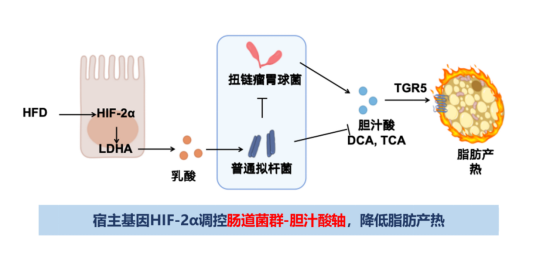
图3. 肠道HIF-2α通过重塑肠道微环境调控菌群
深入分析发现,HIF-2α敲除小鼠的肠道菌群结构发生了重塑,其中普通拟杆菌丰度显著增加。那么,改变后的菌群通过何种机制改善肥胖?研究指向了胆汁酸代谢:HIF-2α敲除小鼠体内,由菌群代谢产生的次级胆汁酸(如DCA和LCA)水平升高。这些胆汁酸能够激活脂肪组织中的G蛋白偶联胆汁酸受体(TGR5),进而促进白色脂肪组织的“米色化”和产热,增加能量消耗,从而实现减重效果。这一研究完整地描绘了“宿主肠道HIF-2α→乳酸↓→普通拟杆菌↑→次级胆汁酸↑→脂肪TGR5激活→产热增加→肥胖改善”的全新调控通路。
结 语
从“肠-血管”相互作用,到“宿主-菌群”反向调控,再到“环境-菌群-宿主”致病轴,这些研究不仅发现了胆汁酸、神经酰胺、乳酸等关键信号分子,还明确了肠FXR、SMPD3、HIF-2α等新的药物靶点,为“代谢性疾病肠治”理论提供了坚实的科学依据。
房中则教授团队不仅深入探索基础机制,还成功实现了临床转化:将神经酰胺开发为检测试剂盒并推向市场,用于心血管疾病风险评估,完美诠释了“实验室到病床旁”的转化医学理念。这些工作加深了我们对代谢性疾病复杂性的认识,为基于肠道菌群的个性化干预策略提供了可能。相信随着“第二基因组”奥秘的逐步揭示,人类将迎来战胜代谢性疾病的新希望。
- 推荐文章
