- 首页 > 正文
醛固酮靶向治疗:在难治性高血压与慢性肾脏病中实现早期干预的新范式
发表时间:2026-02-04 13:06:08
编者按
难治性高血压(TRH)常与慢性肾脏病(CKD)共存,两者并存显著增加不良心血管事件和终末期肾病(ESKD)的风险。作为肾素-血管紧张素-醛固酮系统(RAAS)的关键效应激素,醛固酮过量不仅导致水钠潴留、血压升高,更通过直接的促炎、促纤维化作用,独立于血压之外损害心肾功能。近期发表在European Heart Journal的一篇综述,系统阐述了在TRH与CKD患者中早期实施醛固酮靶向治疗的必要性与临床获益。本文基于该文献,梳理了醛固酮介导心肾损伤的核心机制,解读现有循证证据,并探讨在真实世界中克服治疗障碍的创新策略,供同道参考。
TRH和CKD是临床常见的共病状态,二者相互促进,显著增加患者心血管和肾脏不良结局的风险。多项大型观察性研究显示,CKD患者中TRH的患病率显著升高。例如,REGARDS研究发现,估算肾小球滤过率(eGFR)<45 ml/(min·1.73 m2)患者的TRH患病率达33.4%,而在尿白蛋白/肌酐比值(UACR)≥300 mg/g的患者中高达48.3%;CRIC研究显示,eGFR每降低5 ml/(min·1.73 m2),TRH发生风险增加4%。反之亦然,TRH患者进展至ESKD的风险也显著增加,研究表明,TRH患者的ESKD风险较非TRH患者升高约2倍。
醛固酮:心肾功能恶化的推手
醛固酮通过上调上皮钠通道(ENaC)和Na/K-ATP酶泵,导致钠重吸收增加和血压升高。醛固酮还通过抑制内皮一氧化氮合酶活性、增加氧化应激并降低一氧化氮生物利用度来损害内皮功能。此外,醛固酮通过增加血管肌源性张力和血管细胞中促炎细胞因子的表达,促进血管平滑肌细胞的增殖和动脉壁胶原沉积,从而促进动脉僵硬度的发展。
醛固酮在肾脏炎症、组织重塑和纤维化中的作用也已得到充分证实。醛固酮通过激活盐皮质激素受体(MR),引起肾小球硬化和肾动脉硬化。某些情况下,如肥胖、糖尿病等代谢异常状态下,11β-HSD2酶活性下降,使得皮质醇得以激活MR,进一步加剧器官损伤。
需要注意的是,虽然血管紧张素转换酶抑制剂(ACEi)或血管紧张素受体拮抗剂(ARB)可以抑制醛固酮(图1),但长期(>6个月)应用后醛固酮往往出现“反弹”,即醛固酮逃逸,提示仅阻断上游RAS不足以改善患者预后。
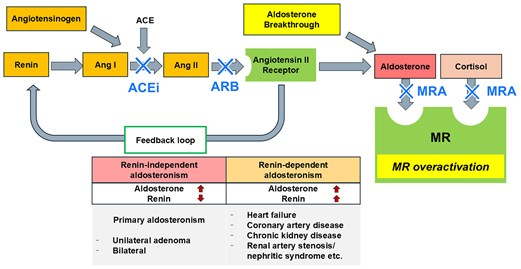
图1. 肾素非依赖性和依赖性醛固酮增多症
循证基石:醛固酮靶向治疗的显著获益
针对醛固酮的治疗,主要通过两大类药物实现:MRA和ASI。其中,MRA是目前临床应用最广泛的手段。
1. 传统MRA(螺内酯、依普利酮):多项大型随机对照试验(RCT)奠定了MRA在心肾保护中的地位。例如,在心力衰竭患者中,螺内酯(RALES研究)和依普利酮(EMPHASIS-HF研究)均显著降低了心血管死亡和心衰住院风险。更重要的是,这些获益在不同肾功能水平的患者中均存在。MIRAD等研究的分析显示,MRA能有效降低2型糖尿病(T2D)和高心血管风险患者的尿白蛋白排泄,延缓CKD进展。HOMAGE试验的探索性分析也提示,在心衰风险人群中,早期应用螺内酯可能对肾功能变化产生有益影响。
2. 新型非甾体类MRA:非奈利酮的出现,为CKD合并T2D患者带来了新的治疗选择。整合了FIDELIO-DKD和FIGARO-DKD研究的FIDELITY汇总分析证实,非奈利酮在标准治疗基础上,能显著降低CKD合并T2D患者的肾衰竭、心血管死亡、非致死性心肌梗死和心衰住院等复合终点风险。其获益在不同基线eGFR和UACR水平的患者中均得到证实,且对心衰风险的降低尤为突出。FIGARO-DKD研究的亚组分析进一步显示,非奈利酮可显著降低新发心力衰竭的风险。
3. 醛固酮合酶抑制(ASI):ASI通过抑制抑制激素合成而非阻断MR来发挥作用。临床试验(如Target-HTN研究)表明,新型ASI药物lorundrostat能在未控制的高血压患者中剂量依赖性地降低收缩压,且严重高钾血症的发生率较低。这为无法耐受MRA或需要更强效醛固酮抑制的患者提供了新的治疗选择。目前,多项Ⅲ期临床试验正在积极探索ASI与钠葡萄糖共转运蛋白2抑制剂(SGLT2i)联用,在心力衰竭和CKD患者中的疗效与安全性,未来有望开启联合治疗的新篇章。
这些证据表明:醛固酮靶向治疗,特别是MRA的应用,不仅能有效控制血压,更能为TRH和CKD患者提供超越降压的心肾双重保护。
现实困境与破局之道:实现早期实施
尽管证据确凿,但MRA在临床实践中的应用仍面临巨大挑战,尤其是在CKD患者中,高钾血症的风险是限制其使用和剂量滴定的主要障碍。
为解决这一困境,新型钾结合剂的出现提供了关键的破局思路。AMBER研究是一项里程碑式的Ⅱ期随机对照试验,该研究评估了钾结合剂Patiromer在启用螺内酯治疗中的作用。结果显示,与安慰剂相比,Patiromer能显著降低CKD合并TRH患者在使用螺内酯后发生高钾血症的风险,从而使得更多患者能够安全地接受并维持这一具有心肾保护作用的治疗。这一策略为在高风险人群中实现MRA的“早期实施”铺平了道路。
此外,临床医生需认识到,对MRA的监测不应仅限于血钾,还应关注肾功能变化。EMPHASIS-HF等研究的事后分析表明,治疗初期出现的eGFR急性下降多为血流动力学效应,通常是一过性的,不应成为停药的理由,反而可能预示着长期获益。
结语
综上所述,对于合并TRH和CKD的患者,醛固酮是驱动心肾共病进展的核心病理因素。基于坚实的循证医学证据,早期实施醛固酮靶向治疗,特别是应用MRA,是改善此类患者长期预后的关键策略(图2)。面对高钾血症的挑战,联合使用钾结合剂等创新管理方案,有望突破临床应用瓶颈,让更多患者从这一“基石性”治疗中获益。未来的研究应继续探索更优的治疗策略和风险分层模型,以实现个体化、精准化的治疗目标。
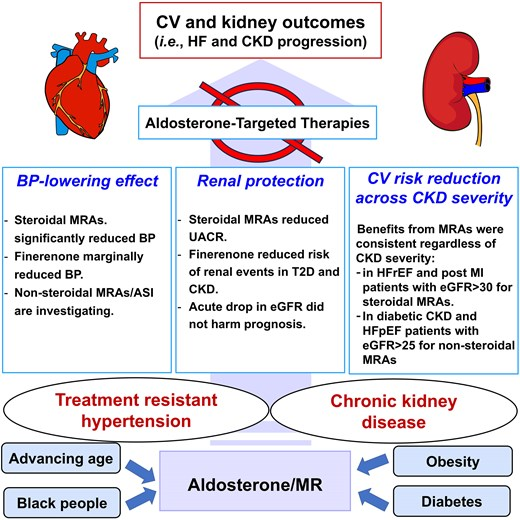
图2. 在TRH和CKD患者中早期实施醛固酮靶向治疗
文献索引:Kobayashi M, et al. Eur Heart J. 2025 Jul 14;46(27):2618-2642. doi: 10.1093/eurheartj/ehaf225.
- 推荐文章
