- 首页 > 正文
肾例明鉴 | 原发性干燥综合征合并冷球蛋白血症性肾小球肾炎伴非弥漫性膜增生性肾小球肾炎样病变一例
发表时间:2026-02-04 13:53:28
原发性MPGN中,系膜和毛细血管增生表现为弥漫性、球形改变;而继发性MPGN的病变以局灶性和节段性为主。继发性MPGN(如Ⅳ型狼疮性肾炎)在Ⅳ型节段性和Ⅳ型全球性病变中可能表现为非弥漫性MPGN样改变。目前尚无关于pSS继发的冷球蛋白血症性肾小球肾炎(GN)中存在局灶性(非弥漫性)MPGN的报道。中国人民解放军总医院第一医学中心Zhi-Yu Duan等在Front Immunol. 上报道了一例pSS合并冷球蛋白血症并导致冷球蛋白血症性GN的病例。
该患者光镜下66.7%的肾小球可见MPGN样病变,25%的肾小球可见系膜增生性肾小球肾炎(MsPGN)样病变;电镜证实为MsPGN,最终诊断为MPGN。本病例为临床中类似冷球蛋白血症性GN所致的非典型MPGN样病变(尤其是光镜与电镜诊断不一致的病例)提供了病理诊断依据和诊疗思路。

一、病例介绍
患者女性,52岁,患有原发性干燥综合征(pSS)2年,既往无肾脏受累病史。2022年7月出现咳嗽、咳痰,体温38.5°C,同时伴有眼睑水肿和高血压(血压182/100 mmHg)。当地医院胸部计算机断层扫描显示双肺多发斑片状实变影。实验室检查结果:血清肌酐94.2 μmol/L,血清白蛋白 34.2 g/L;抗核抗体(ANA)滴度1:320,补体C3为0.468 g/L,补体C4为0.0107 g/L,类风湿因子(RF)678 IU/ml;抗双链DNA(dsDNA)抗体和抗平滑肌(SM)抗体均为阴性;B型脑钠肽>35 000 pg/ml;尿常规示蛋白尿(2+)、血尿(2+)。
患者在当地医院接受治疗,包括抗感染治疗、茴三硫及羟氯喹,但1周内出现全身水肿加重、尿量减少、体重增加10 kg,并进展为夜间胸闷和端坐呼吸,随后转入作者医院住院治疗。入院时,患者体温38.4°C,呈半卧位,双肺听诊可闻及明显湿啰音。
实验室检查:白细胞计数15.15×109/L,中性粒细胞百分比89.4%,血红蛋白98 g/L;血清白蛋白22.1 g/L,血清肌酐升至327.3 μmol/L(表1);C反应蛋白152.11 mg/L,降钙素原0.403 ng/ml,血沉38 mm/h。
表1. 实验室数据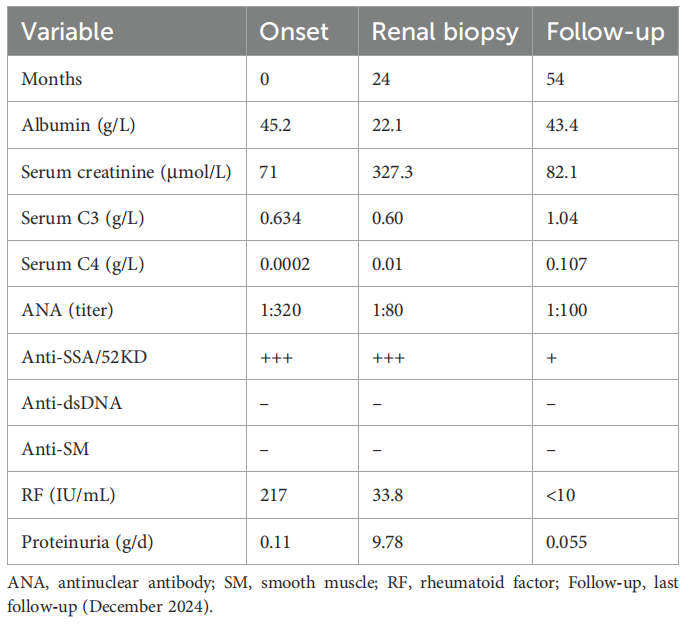
进一步免疫学检查:ANA滴度1:80,抗SSA/52KD阳性(3+),补体C30.6 g/L,补体C40.01 g/L,免疫球蛋白G(IgG)3.67 g/L,RF33.8 IU/ml;直接抗人球蛋白试验(Coombs试验)阴性;抗dsDNA、抗SM、抗SSA/60KD、抗SSB、抗核糖体、抗U1RNP、抗中性粒细胞胞浆抗体(ANCA)及抗肾小球基底膜(抗GBM)抗体均为阴性。血免疫固定电泳可见单克隆IgMκ型。尿沉渣镜检:红细胞30~40个/高倍视野,40%呈多形性(以环形为主)。24小时尿蛋白定量7.72~9.78 g。胸部计算机断层扫描显示双肺肺炎伴气道扩张不全。乙型肝炎、丙型肝炎、梅毒抗体、人类免疫缺陷病毒(HIV)抗体、严重急性呼吸综合征冠状病毒2核酸、甲型及乙型流感病毒抗体、肺炎支原体抗体检测均为阴性。经抗感染治疗后,患者3天内尿量逐渐增多,水肿消退,体温恢复正常。
2022年8月行肾活检,共见12个肾小球,其中1个肾小球硬化(图1)。其余肾小球可见中至重度弥漫性系膜细胞及基质增生;8个肾小球呈结节分叶状改变,节段毛细血管内细胞增多伴少量中性粒细胞浸润;8个肾小球(66.7%)可见弥漫性基底膜增厚伴双轨征;3个肾小球(25%)仅见轻度系膜细胞及基质增生,无结节分叶状改变;1个肾小球血管袢可见过碘酸-雪夫(PAS)染色强阳性的微血栓。肾小管上皮细胞可见空泡及颗粒变性,伴多灶性淋巴细胞、单核细胞浸润。小动脉内膜可见黏液变性及节段性纤维素样坏死,管腔狭窄、闭塞。免疫荧光:IgM(3+)、IgG(1+)、C3(3+)、C1q(2+)、κ链(3+)、λ链(1+),IgA阴性;阳性免疫反应物主要分布于系膜区,沿毛细血管袢呈颗粒状沉积。光镜所见符合免疫复合物介导的膜增生性肾小球肾炎(MPGN)。免疫组织化学:肾小球内CD68强阳性(图1K)。电镜:轻至中度系膜细胞及基质增生,节段性内皮细胞增生,系膜区及节段内皮下可见块状电子致密物沉积;毛细血管袢内可见无明确亚结构的冷球蛋白沉积;多数基底膜疏松层轻度增宽,足突部分融合。电镜所见提示系膜增生性肾小球肾炎(MsPGN)伴内皮细胞损伤。结合光镜及电镜结果,诊断为膜增生性肾小球肾炎。冷球蛋白检测示Ⅱ型冷球蛋白阳性,伴多克隆IgG-λ、IgG-κ及单克隆IgM-κ。患者接受环磷酰胺联合甲泼尼龙治疗,环磷酰胺累计总剂量为12 g。
2024年12月随访时,冷球蛋白检测阴性;血清肌酐82.1 μmol/L,补体C31.04 g/L,补体C40.107 g/L,IgG10.6 g/L;RF<10 IU/ml;24小时尿蛋白定量0.055 g。
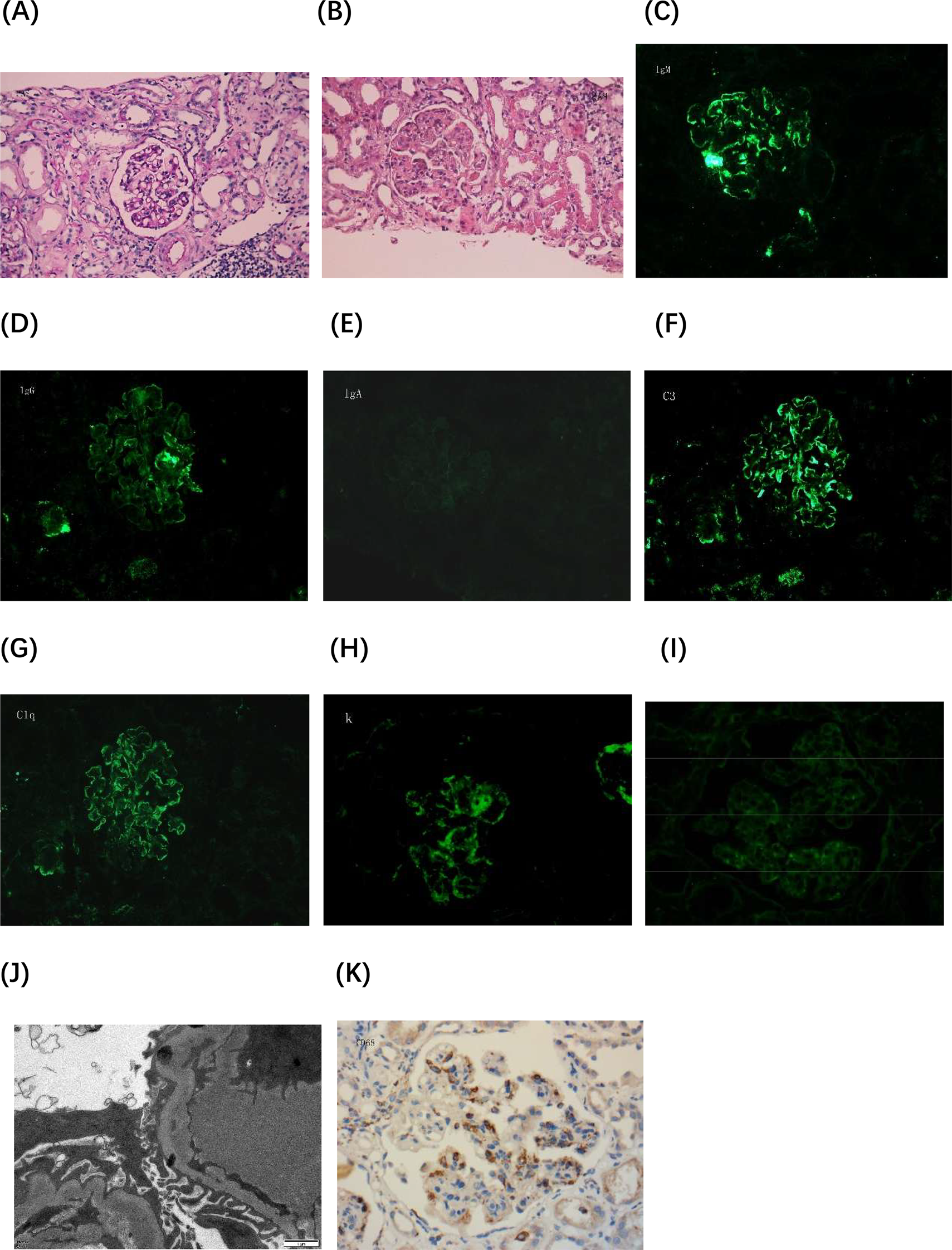
图1. 肾活检组织病理学检查。(A)过碘酸-雪夫(PAS)染色图1显示系膜细胞及基质轻度增生,无系膜插入及双轨征(×400)。(B)PAS染色图2显示肾小球内系膜细胞及基质弥漫性增生,伴系膜插入及双轨征形成,肾小球呈分叶状外观,毛细血管袢内可见微血栓(×400)。(C-I)免疫荧光图:(C)IgM(×400),(D)IgG(×400),(E)IgA(×400),(F)C3(×400),(G)C1q(×400),(H)κ轻链(×400),(I)λ轻链(×400)。(J)电镜图显示内皮下有簇状电子致密物沉积,毛细血管袢内可见微血栓形成,密度均匀,无明确亚结构(×15,000)。(K)免疫组织化学图显示肾小球内CD68强阳性(×400)。λ轻链、κ轻链及CD68染色均在石蜡包埋切片上进行。
二、病例讨论
该患者有2年pSS病史,既往无蛋白尿或血尿。2022年7月肺部感染后,抗核抗体(ANA)滴度为1:320,肾活检显示膜增生性肾小球肾炎(MPGN)样病变(若归类为IV型狼疮性肾炎(LN),评分为10分)。补体C3和C4同时降低提示可能存在系统性红斑狼疮(SLE)。影响该患者SLE诊断的关键因素在于其MPGN样病变是否可归类为IV型LN,若不能,则SLE诊断无法成立。患者存在Ⅱ型冷球蛋白血症阳性,而冷球蛋白血症性肾小球肾炎(GN)也可表现为MPGN。冷球蛋白血症可能导致补体C3和C4水平降低。
多项因素不支持SLE诊断:
患者发病后抗双链DNA(dsDNA)、抗平滑肌(SM)及抗核糖体P蛋白持续阴性。这种血清学特征是SLE与pSS的关键鉴别点。
肾脏免疫荧光未呈现“满堂亮”(full house)模式。
电镜未发现上皮下电子致密物沉积,也未观察到管腔网状包涵体。
狼疮性肾炎的免疫荧光通常以IgG为主。而该患者IgM的荧光强度明显强于IgG,这是冷球蛋白血症性GN与狼疮性肾炎的关键鉴别特征。
除口干、眼干症状外,患者无其他SLE临床表现(如白细胞减少、血小板减少、自身免疫性溶血、关节痛、口腔溃疡、皮疹或盘状红斑)。
因此,不支持SLE诊断。病情加重可能由肺部感染诱发,进而加剧冷球蛋白血症并导致冷球蛋白血症性GN。
MPGN是pSS相关的第二常见肾脏疾病。原发性MPGN中,系膜和毛细血管增生表现为弥漫性、球形改变;而继发性MPGN的病变以局灶性和节段性为主。继发性MPGN(如Ⅳ型狼疮性肾炎)可能表现为非弥漫性MPGN样病变。本例中,光镜下超过50%的肾小球显示MPGN样病变,而部分仅表现为轻度系膜细胞和基质增生。光镜与电镜的诊断并不完全一致。在冷球蛋白血症性GN早期,免疫复合物介导的血栓阻塞肾小球毛细血管,且并非所有沉积物都具有明确的亚结构,这是冷球蛋白血症性GN的特征性病理表现。本病例中,肾小球毛细血管袢检测到过PAS染色强阳性的微血栓,电镜也证实毛细血管袢内存在冷球蛋白。此外,肾小球内单核细胞/巨噬细胞浸润是活动性冷球蛋白血症性GN的标志,免疫组织化学显示肾小球内CD68强阳性。免疫荧光分析显示IgM和κ轻链表达占优势,同时伴有IgG、C3、C1q和λ阳性,提示血液中存在单克隆IgMκ。在冷球蛋白血症性GN中,电子致密物沉积更常见于内皮下区和系膜区,而上皮下和膜内沉积较少见。
患者病情加重可能由肺部感染诱发。既往研究表明,肺部感染可显著提高pSS患者的欧洲抗风湿病联盟干燥综合征疾病活动指数评分。此外,感染可升高慢性活动性丙型肝炎患者的Ⅱ型冷球蛋白水平,导致冷球蛋白血症性GN发作。本例患者肺部感染后,类风湿因子(RF)水平显著升高,出现Ⅱ型冷球蛋白血症阳性,并发生急性肾损伤和肾病综合征。肾活检证实了冷球蛋白血症性GN的诊断。抗感染治疗后,RF和尿蛋白水平迅速下降,补体C3、补体C4和血清肌酐恢复正常。感染可能是加剧pSS患者冷球蛋白血症并诱发冷球蛋白血症性GN的关键因素。既往文献也报道过由肺部感染引起的冷球蛋白血症性GN病例。临床医生应对发生感染的pSS患者进行更密切的监测,并尽早给予抗感染治疗。
据作者所知,这是首例报道的继发于pSS的非弥漫性MPGN合并冷球蛋白血症性GN病例。感染可能在加剧冷球蛋白血症和诱发冷球蛋白血症性GN中发挥关键作用。
来源:Front Immunol. 2025 May 26;16:1610017. doi: 10.3389/fimmu.2025.1610017
- 推荐文章
