- 首页 > 正文
CSE 2025 | 洪天配教授:GLP-1受体激动剂对胰岛β细胞的影响:改善功能还是延缓衰竭?
发表时间:2026-02-04 14:30:52
在中华医学会第二十二次内分泌学学术会议(CSE 2025)上,北京大学第三医院内分泌科洪天配教授以《GLP-1受体激动剂对胰岛β细胞的影响:改善功能还是延缓衰竭?》为题,系统梳理了该领域的最新研究进展。本文基于洪教授的精彩报告,结合基础与临床研究证据,深入探讨GLP-1RA在改善β细胞功能、促进β细胞再生方面的机制与应用潜力,旨在为临床医生提供更深层次的科学视角。

早在1964年,Elrick等人的研究便通过对比口服与静脉输注葡萄糖后胰岛素分泌的差异,首次验证了“肠促胰素效应”的存在——即在相同血糖水平下,口服葡萄糖能诱导更强的胰岛素分泌,提示肠道分泌的激素在调节胰岛功能中扮演关键角色[1]。这一发现为后续肠促胰素的研究奠定了基础。
胰高糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)是两种主要的肠促胰素。GLP-1由肠道L细胞分泌,在体内可被二肽基肽酶-4(DPP-4)快速降解,其生物活性形式GLP-1(7-37)和GLP-1(7-36)amide的半衰期仅2.1~2.4分钟[2]。为克服这一局限,一系列GLP-1受体激动剂(GLP-1RA)相继问世,包括艾塞那肽、利拉鲁肽、度拉糖肽、司美格鲁肽等,通过结构修饰延长半衰期,实现日制剂或周制剂的临床应用[3]。
二、GLP-1RA改善胰岛β细胞功能的临床与机制证据
多项临床研究证实,GLP-1RA能显著改善2型糖尿病(T2D)患者的胰岛β细胞功能。如LEAD-4研究显示,利拉鲁肽治疗可显著升高HOMA-β指数,同时降低胰岛素原/胰岛素比值[4](图1),提示其不仅增强胰岛素分泌能力,还改善了胰岛素的生物合成与加工成熟过程。
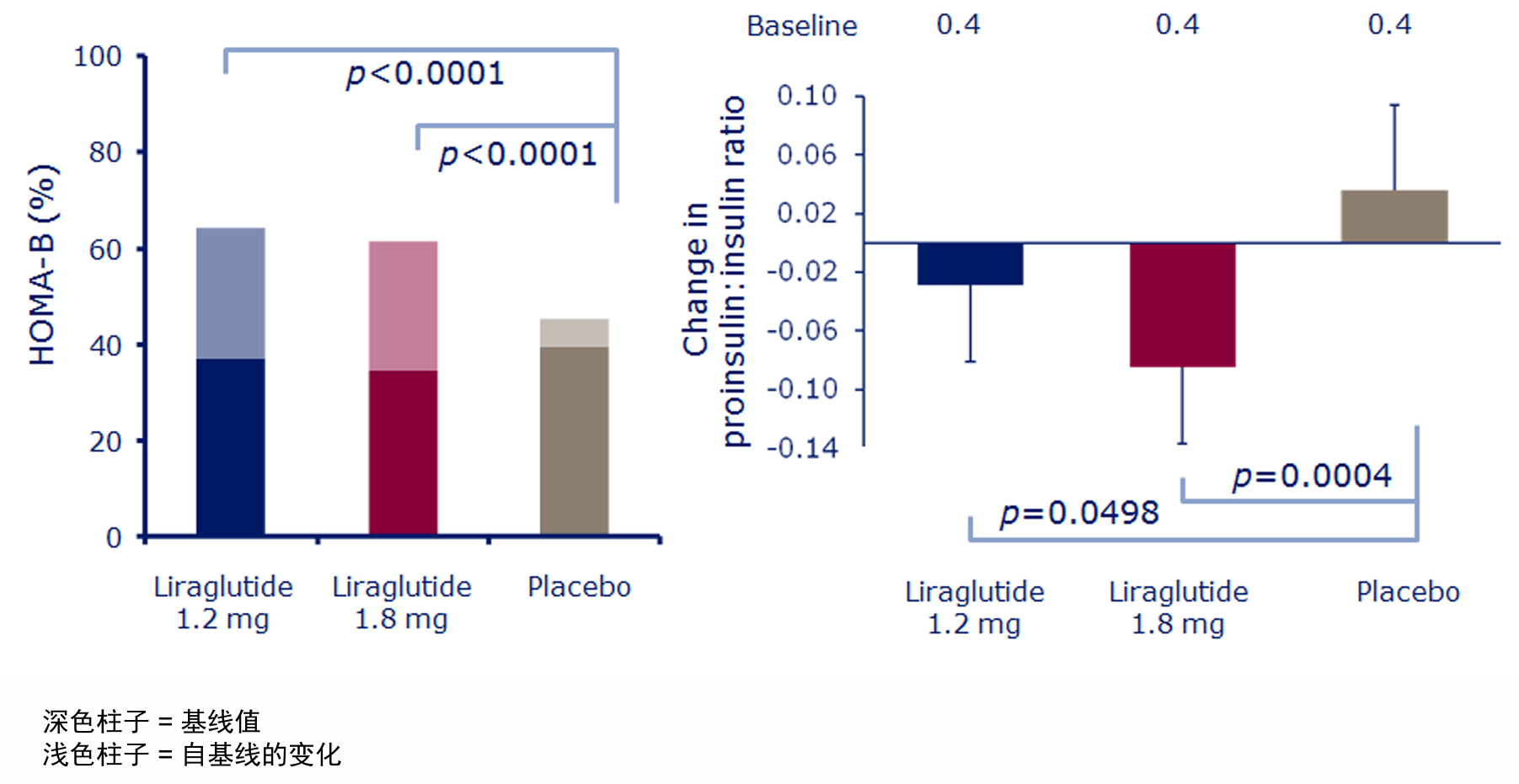
图1. 利拉鲁肽与HOMA-β指数和胰岛素原/胰岛素比值的关系
基础研究进一步揭示了其分子机制。胰岛素的生物合成始于胰岛素原,经激素原转化酶PC1/3和PC2剪切后形成成熟的胰岛素与C肽。PAX6基因突变可导致PC1/3表达减少,进而引起胰岛素原剪切障碍和糖代谢异常[5]。研究证实,利拉鲁肽可通过激活GLP-1受体(GLP-1R),经cAMP-PKA信号通路,上调PC1/3和PC2的表达,促进胰岛素原向成熟胰岛素的转化,从而改善胰岛β细胞功能[6]。
三、GLP-1RA促进胰岛β细胞再生:来自动物实验和机制研究的证据
除改善胰岛β细胞功能外,GLP-1RA是否能促进β细胞再生,是近年来研究的前沿方向。在T2D动物模型中,艾塞那肽已被证实可促进GK大鼠的β细胞再生[7]。
引人注目的是,近年研究发现,胰高糖素受体(GCGR)单抗不仅可通过抑制胰高糖素作用降低血糖,还能显著促进胰岛β细胞再生。GCGR单抗在1型糖尿病(T1D)和T2D小鼠模型中均能增加β细胞总量,并通过胰岛α细胞向β细胞转分化、胰腺内分泌前体细胞(如Ngn3+细胞)分化为新生β细胞等途径而实现β细胞再生[8,9]。机制研究发现,GCGR单抗可显著升高循环中活性GLP-1水平,并促进胰岛α细胞产生GLP-1[10]。更重要的是,这一促再生效应可被GLP-1R拮抗剂及全身性或胰腺特异性敲除GLP1R基因所阻断(图2),证实胰腺旁分泌的GLP-1/GLP-1R信号通路是介导GCGR单抗诱导β细胞再生的关键机制[11]。
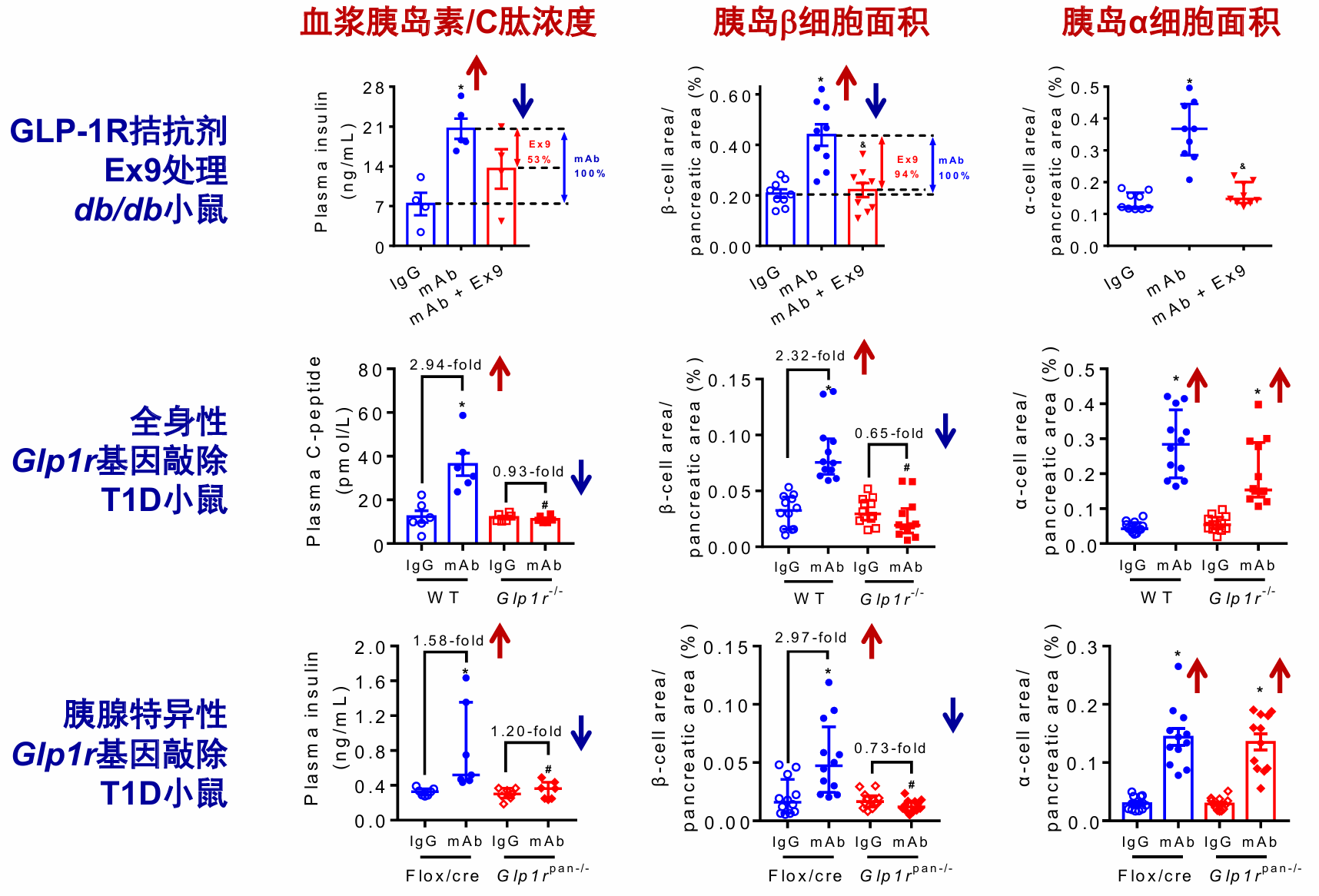
图2. GLP-1R参与介导GCGR单抗所致的胰岛β细胞再生
此外,Fam3a通过Nr4a2-Foxa2通路反向调控胰岛α细胞Pcsk1/3(编码PC1/3)表达,使α细胞产生的主要激素从胰高糖素转变为GLP-1(PC2和PC1/3分别介导胰高糖素原剪切为胰高糖素和GLP-1),进一步揭示了GLP-1产生的复杂调控网络[12]。
四、SGLT2抑制剂与肠道菌群:间接激活GLP-1通路的新路径
研究发现,虽然胰岛β细胞不表达SGLT2,但SGLT2抑制剂达格列净却能促进T2D小鼠β细胞再生,其机制可能是通过某种循环因子介导[13]。
进一步研究显示,达格列净可重塑db/db糖尿病小鼠的肠道菌群,并且调节与色氨酸代谢相关的肠道菌群及其代谢物(尤其是L-色氨酸)水平,这些菌群代谢物可促进肠道L细胞分泌GLP-1,形成“肠道菌群–色氨酸代谢–GLP-1”调控轴,激活GLP-1R及其下游信号,从而促进胰岛β细胞再生[14] (图3)。
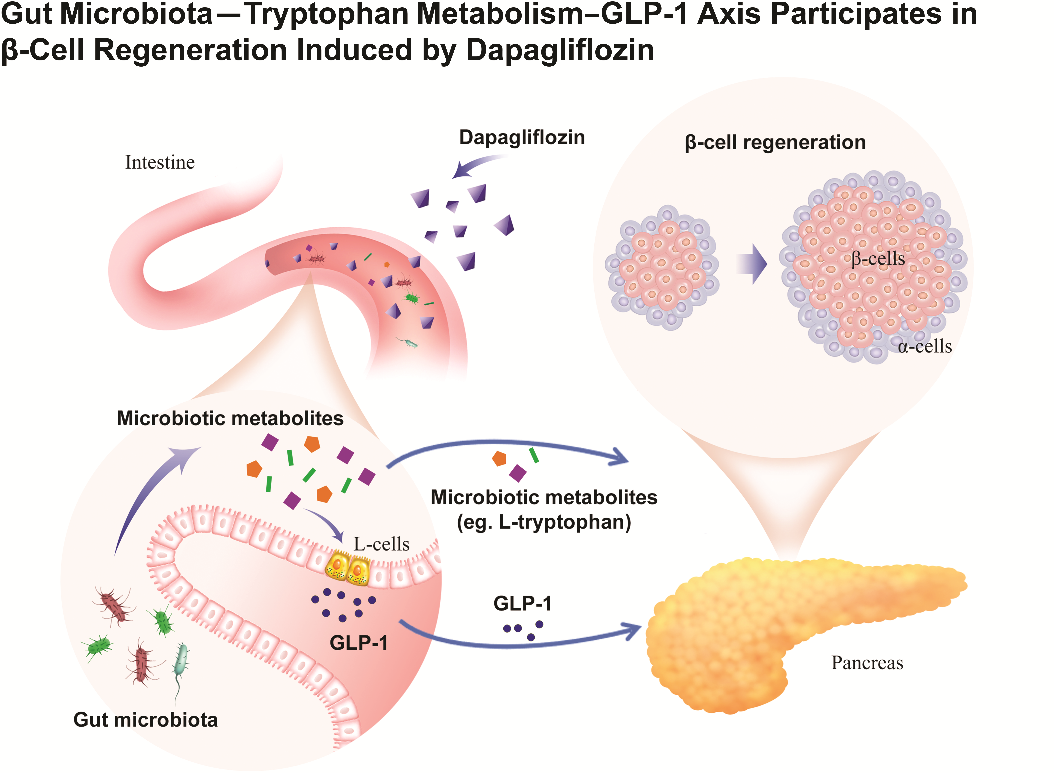
图3. 肠道菌群-色氨酸代谢-GLP-1轴参与介导达格列净促进胰岛β细胞再生
五、迈向人类胰岛β细胞再生:联合治疗的新策略
尽管动物模型研究提供了有力证据,但人类胰岛β细胞的再生能力相对有限。近年的研究进展为突破这一瓶颈带来新希望。
近期的研究表明,GLP-1RA与DYRK1A(双重特异性酪氨酸调节激酶1A)抑制剂联合使用,可显著促进正常和T2D原代人类胰岛β细胞增殖。在移植人类胰岛的小鼠模型中,该联合治疗可使人类移植物β细胞体积增加3~7倍,显著改善葡萄糖耐量,增加人类胰岛素分泌,且不增加低血糖风险[15,16]。早期干预效果更优,提示治疗时机的重要性。此外,人类遗传学研究也支持GLP-1/GLP-1R通路的重要性。GLP1R基因变异(rs10305492)与T2D和冠心病风险降低显著相关(图4),且与空腹血糖降低相关,其效应堪比GLP-1RA[17],进一步佐证了靶向GLP-1R的长期临床价值。
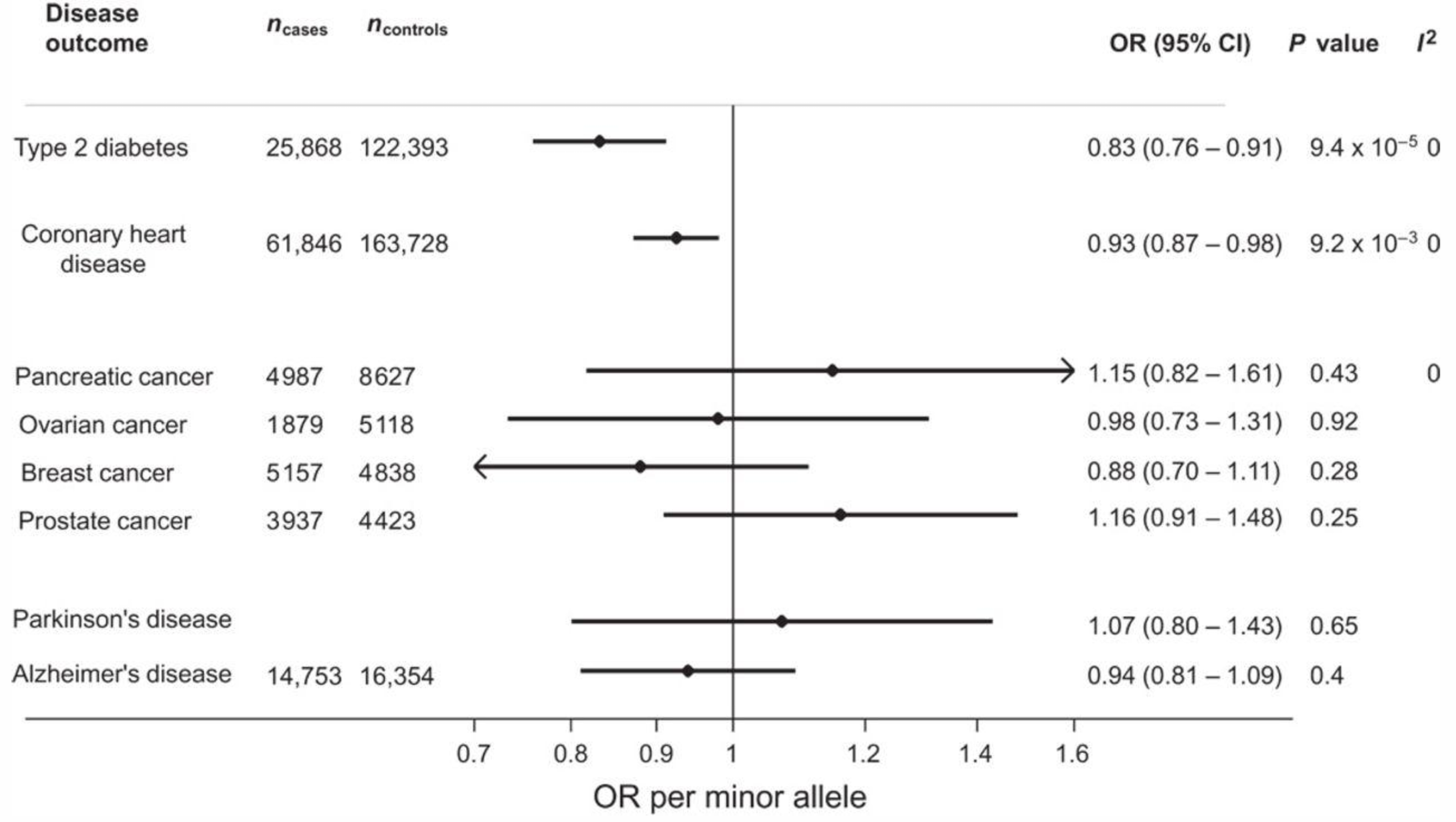
图4. GLP1R基因变异与T2D和冠心病风险降低显著相关
总结
综合现有证据,GLP-1RA对胰岛β细胞具有多重保护作用:一方面,通过GLP-1R-cAMP-PKA通路促进胰岛素生物合成、胰岛素原剪切加工及成熟胰岛素分泌,从而改善β细胞功能;另一方面,在特定条件下,可通过直接或间接机制(如联合DYRK1A抑制剂、调控肠道菌群等),促进β细胞增殖、α细胞向β细胞转分化及β细胞新生,增加β细胞数量。这些作用共同构成了GLP-1RA延缓β细胞衰竭、甚至实现功能逆转的生物学基础。未来,如何将这些基础研究成果转化为临床可推广应用的再生疗法,将是糖尿病治疗领域的重要方向。
参考文献
[1] ELRICK H, et al. PLASMA INSULIN RESPONSE TO ORAL AND INTRAVENOUS GLUCOSE ADMINISTRATION. J Clin Endocrinol Metab. 1964 Oct;24:1076-82.
[2] Pridal L, et al. Glucagon-like peptide-1(7-37) has a larger volume of distribution than glucagon-like peptide-1(7-36)amide in dogs and is degraded more quickly in vitro by dog plasma. Eur J Drug Metab Pharmacokinet. 1996 Jan-Mar;21(1):51-9.
[3] Andersen A, et al. Glucagon-like peptide 1 in health and disease. Nat Rev Endocrinol. 2018 Jul;14(7):390-403.
[4] Zinman B, et al. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in combination with metformin and thiazolidinedione in patients with type 2 diabetes (LEAD-4 Met+TZD). Diabetes Care. 2009 Jul;32(7):1224-30.
[5] Wen JH, et al. Paired box 6 (PAX6) regulates glucose metabolism via proinsulin processing mediated by prohormone convertase 1/3 (PC1/3). Diabetologia. 2009 Mar;52(3):504-13.
[6] Wang L, et al. GLP-1 analog liraglutide enhances proinsulin processing in pancreatic β-cells via a PKA-dependent pathway. Endocrinology. 2014 Oct;155(10):3817-28.
[7] Tourrel C, et al. Persistent improvement of type 2 diabetes in the Goto-Kakizaki rat model by expansion of the beta-cell mass during the prediabetic period with glucagon-like peptide-1 or exendin-4. Diabetes. 2002 May;51(5):1443-52.
[8] Wei R, et al. Antagonistic Glucagon Receptor Antibody Promotes α-Cell Proliferation and Increases β-Cell Mass in Diabetic Mice. iScience. 2019 Jun 28;16:326-339.
[9] Cui X, et al. Pro-α-cell-derived β-cells contribute to β-cell neogenesis induced by antagonistic glucagon receptor antibody in type 2 diabetic mice. iScience. 2022 Jun 9;25(7):104567.
[10] Wei T, et al. Glucagon Acting at the GLP-1 Receptor Contributes to β-Cell Regeneration Induced by Glucagon Receptor Antagonism in Diabetic Mice. Diabetes. 2023 May 1;72(5):599-610.
[11] Wei T, et al. Glucagon Acting at the GLP-1 Receptor Contributes to β-Cell Regeneration Induced by Glucagon Receptor Antagonism in Diabetic Mice. Diabetes. 2023 May 1;72(5):599-610.
[12] Wang D, et al. Fam3a-mediated prohormone convertase switch in α-cells regulates pancreatic GLP-1 production in an Nr4a2-Foxa2-dependent manner. Metabolism. 2025 Jan;162:156042.
[13] Wei R, et al. Dapagliflozin promotes beta cell regeneration by inducing pancreatic endocrine cell phenotype conversion in type 2 diabetic mice. Metabolism. 2020 Oct;111:154324.
[14] Jiang Y, et al, Zhang Z, Hong T, Wei R. Gut Microbiota-Tryptophan Metabolism-GLP-1 Axis Participates in β-Cell Regeneration Induced by Dapagliflozin. Diabetes. 2024 Jun 1;73(6):926-940.
[15] Ackeifi C, et al. GLP-1 receptor agonists synergize with DYRK1A inhibitors to potentiate functional human β cell regeneration. Sci Transl Med. 2020 Feb 12;12(530):eaaw9996.
[16] Rosselot C, et al. Harmine and exendin-4 combination therapy safely expands human β cell mass in vivo in a mouse xenograft system. Sci Transl Med. 2024 Jul 10;16(755):eadg3456.
[17] Scott RA, et al. A genomic approach to therapeutic target validation identifies a glucose-lowering GLP1R variant protective for coronary heart disease. Sci Transl Med. 2016 Jun 1;8(341):341ra76.
- 推荐文章
