编者按:钙化防御(Calciphylaxis)为罕见病,是一种潜在性致死的皮肤血管病,最常见于行透析治疗或近期接受了肾脏移植的终末期肾病(ESRD)患者,因此,其也被称为钙化性尿毒症性小动脉病(CUA)。近期,以南京医科大学第一附属医院为第一作者单位的两项研究成果亮相2025年国际肾脏病学会(ISN)世界肾脏病学大会(WCN 2025)。一项研究的第一作者为王宁宁,旨在通过多维度与人工智能研究应对快速进展性病变进行再生医学的探索;另一项研究第一作者为Xiaoxue Ye,运用多组学分析揭示了人羊膜间充质干细胞治疗的钙化性尿毒症小动脉病患者血浆生物标志物候选分子。

钙化防御的救生之旅:通过多维度与人工智能研究应对快速进展性病变的再生医学探索
【WCN25-643】The lifesaving journey for calciphylaxis: Addressing rapidly progressive attacks with multidimensional and AI research for regenerative medicine
第一作者:王宁宁第一作者单位:南京医科大学第一附属医院
引言
钙化防御,又称钙化性尿毒症性小动脉病(CUA),主要发生在慢性肾脏病(CKD)患者中。这是一种罕见病,其组织学特征为主要发生在皮下组织的微动脉钙化、纤维化和血栓形成。皮肤活检是诊断的金标准,但具有侵入性。由于缺乏能模拟临床表现的动物模型,其深入研究受到阻碍。迄今为止,多学科靶向治疗是其主要治疗方法,但尚无确证的疗法,由于溃疡和感染,一年死亡率高达80%。迫切需要开展教育、探索其机制的新途径,以及采取精确的诊断和治疗措施。
方法
CKD矿物质和骨代谢紊乱(CKD-MBD),特别是血管钙化,在危险因素、发病机制和治疗方法上与钙化防御有一定相似之处。鉴于此,我们在《肾衰竭杂志》(Journal of Renal Failure)上编辑了一篇题为“钙化防御与CKD-MBD:持续的挑战与机遇”的文章合集(AC),可在以下网址查看:https://www.tandfonline.com/journals/irnf20/collections/calciphylaxis-mineral-bone-disease。该文集收录了17篇手稿,其中5篇聚焦于钙化防御,12篇聚焦于CKD-MBD。作者来自中国、加拿大和德国。
结果
该AC中的一系列研究在钙化防御和CKD-MBD、相关心血管事件及治疗策略方面取得了重要发现。然而,血管钙化作为CKD患者常见并发症,并不能完全解释钙化防御的快速进展及其危险预后。
研究强调,对进展性血管损伤的急性影响,包括诱导严重缺血和炎症反应,是与皮肤组织坏死和危及生命的感染相关的关键因素。
由于钙化防御临床表现的异质性,迫切需要探索非侵入性生物标志物,并促进多中心和多学科的合作。
积极倾听患者及其家属的声音,将有助于我们理解早期诊断、疾病进展、治疗反应和研究方向。钙化防御的单一疗法面临挑战。探索安全、有效、经济且可及的治疗策略,如干细胞疗法,具有广阔前景。
基于钙化防御患者的特定分子构成,构建一个结合人工智能(AI)技术的多组学和多维度研究体系,将推进我们对这一毁灭性疾病的理解,并为其量身定制再生治疗策略(图1)。
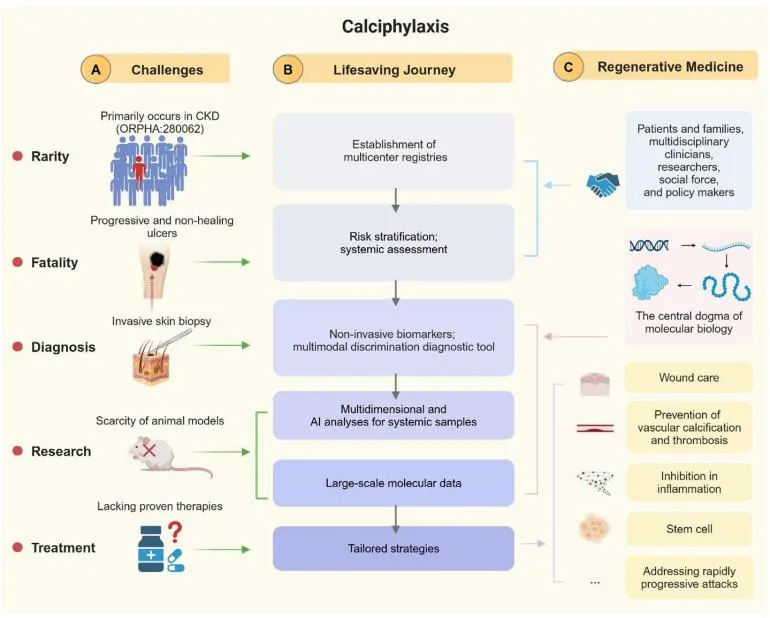
图1. 钙化防御迈向再生医学的救生之路
(引自大会官网摘要:WCN25-643)
结论
应优先研究钙化防御中的缺血和炎症。患者及其家属是制定研究议程的重要成员。拥抱新技术,构建非侵入性诊断和早期预测模型,通过多维度研究确定治疗靶点,并在生物标志物指导下推动再生医学发展,是以人为本的钙化防御救生之旅的北极星。

多组学分析揭示人羊膜间充质干细胞治疗的钙化性尿毒症小动脉病患者血浆生物标志物候选分子
【WCN25-191】MULTI-OMICS ANALYSIS REVEALS PLASMA BIOMARKER CANDIDATES FOR CALCIFIC UREMIC ARTERIOLOPATHY PATIENTS TREATED WITH HUMAN AMNION-DERIVED MESENCHYMAL STEM CELLS
第一作者:Xiaoxue Ye
第一作者单位:南京医科大学第一附属医院
引言
钙化防御是一种进行性缺血性皮肤罕见病(ORPHA:280062),当发生于慢性肾脏病(CKD)患者时又称钙化性尿毒症小动脉病(Calcific Uremic Arteriolopathy,CUA)。该病尚无确证疗法,一年死亡率高达80%。识别非侵入性生物标志物对于优化新型治疗方法至关重要。
方法
我们使用人羊膜间充质干细胞(human Amnion-Derived Mesenchymal Stem Cells,hAMSCs)治疗CUA患者。在一个包含尿毒症患者(n=10)和CUA患者(n=3)的发现队列中,我们进行了深入的血浆蛋白质组学分析,以比较差异表达的蛋白(Differentially Expressed Proteins,DEPs)。我们监测了一例接受hAMSCs治疗15个月的CUA患者血浆蛋白质组的动态变化。对外周血单个核细胞(Peripheral Blood Mononuclear Cells,PBMCs)进行了单细胞转录组测序。在发现队列和验证队列中,通过酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assay,ELISA)测定血浆生物标志物候选分子。皮肤组织通过免疫组织化学(Immunohistochemistry,IHC)染色进行分析(图2)。
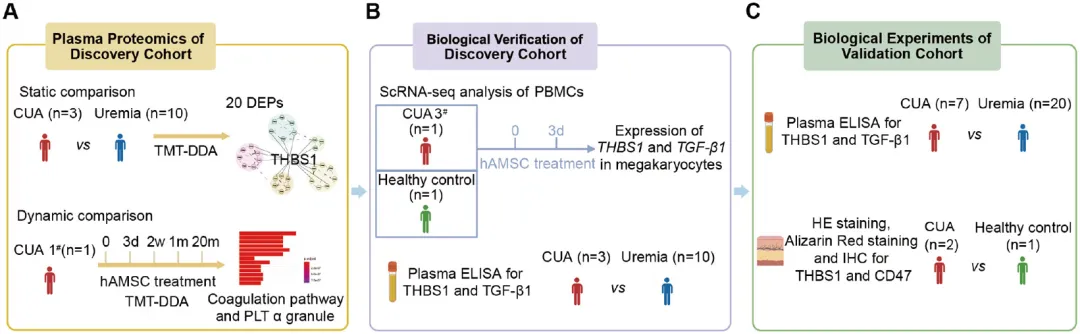
图2. 研究设计
结果
患者1(图3A-3F)和患者3(图3J-3L)在接受hAMSC治疗后皮肤恢复。患者2因COVID-19疫情终止了hAMSC治疗(图3G-3I)。
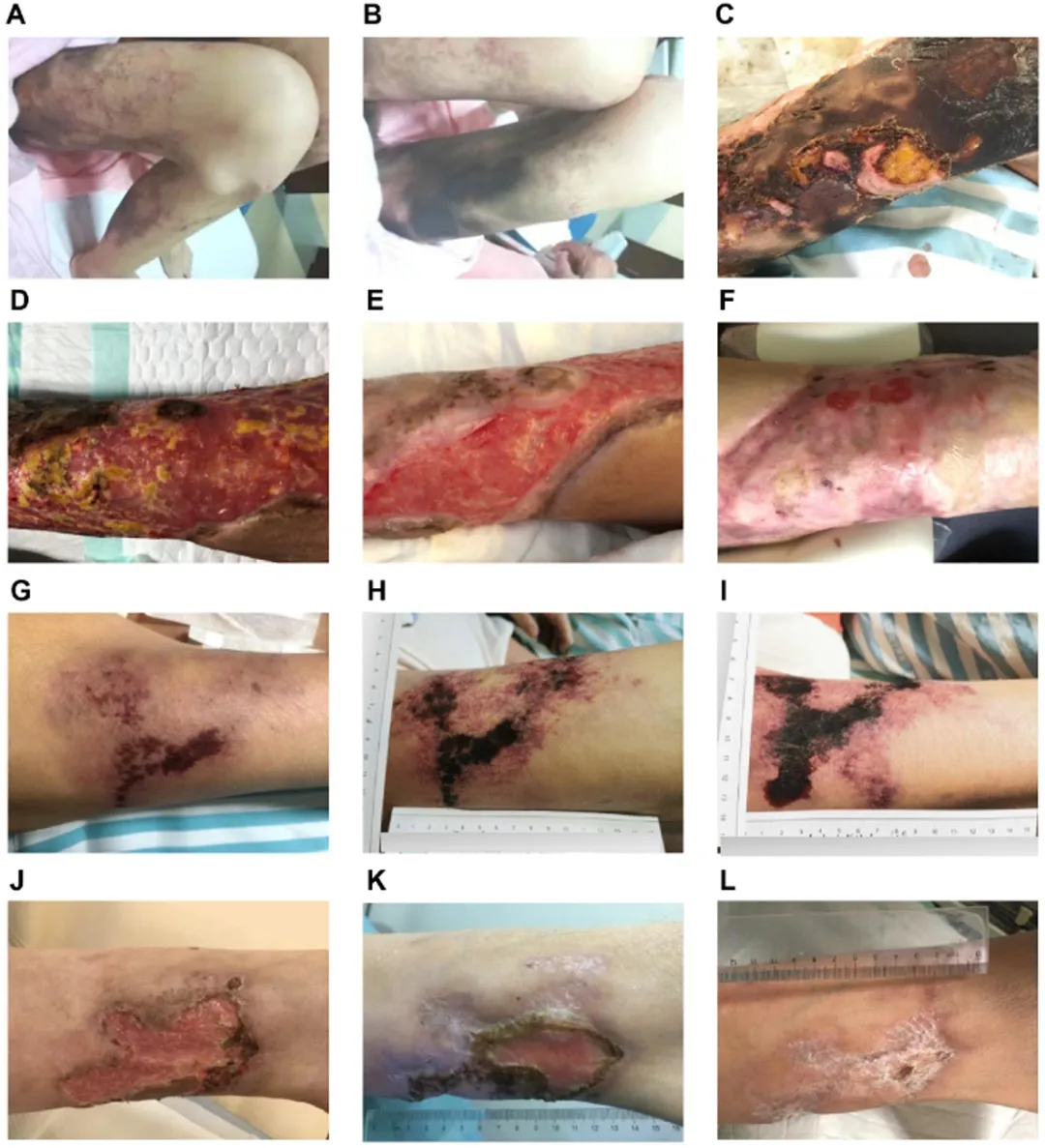
图3. 发现队列中接受hAMSCs治疗的CUA患者的皮损
作为血浆DEP网络中的核心蛋白,血小板反应蛋白1(Thrombospondin 1,THBS1或Tsp-1)在CUA组中上调(图4)。
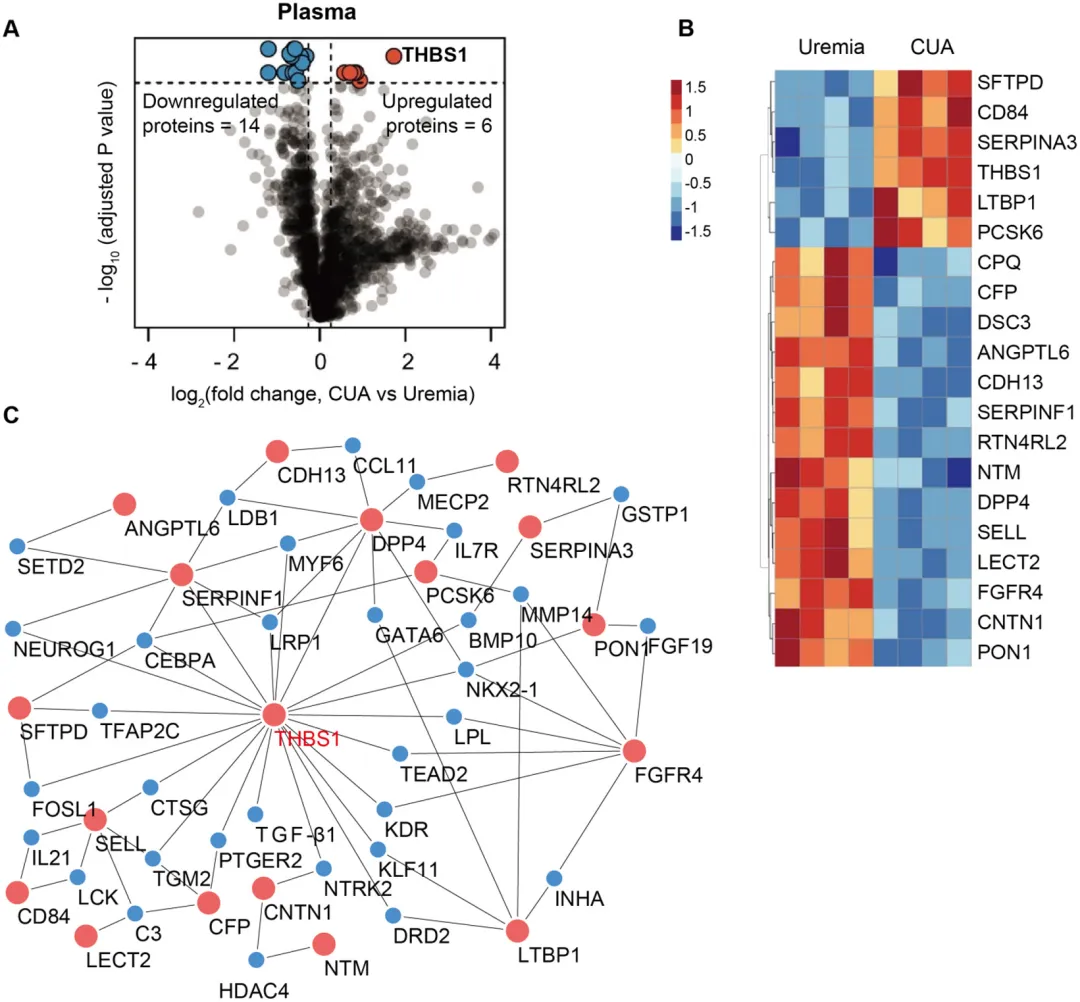
图4. 静态蛋白质组学分析显示THBS1在CUA血浆中发挥关键作用
血浆动态蛋白质组学分析显示,hAMSC治疗3天后,THBS1水平显著降低。潜在转化生长因子-β(Transforming Growth Factor-Beta,TGF-β)结合蛋白1(Latent Transforming Growth Factor-Beta Binding Protein 1,LTBP1)表现出相同的趋势(图5A-5C)。我们使用Mfuzz对所有血浆蛋白进行了聚类。簇4与THBS1和LTBP1的变化相同。基因本体论(Gene Ontology,GO)分析显示与“伤口愈合”“血液凝固”和“血小板α颗粒”高度相关(图5D-5E)。THBS1和TGF-β1是网络中的核心蛋白(图5F)。

图5. 接受hAMSCs治疗的CUA患者血浆核心DEPs及其富集通路
THBS1和TGFB1主要由CUA患者的巨核细胞产生,在hAMSC治疗后迅速下调(图6A-6D)。与尿毒症组相比,通过ELISA测量的CUA组中THBS1/TGF-β1的血浆水平分别增加了11.75倍和10.75倍(图6E)。hAMSC治疗后,虽然CUA患者的血浆THBS1/TGF-β1水平持续较低,但随着干细胞治疗频率的降低,这些水平逐渐升高(图6F)。
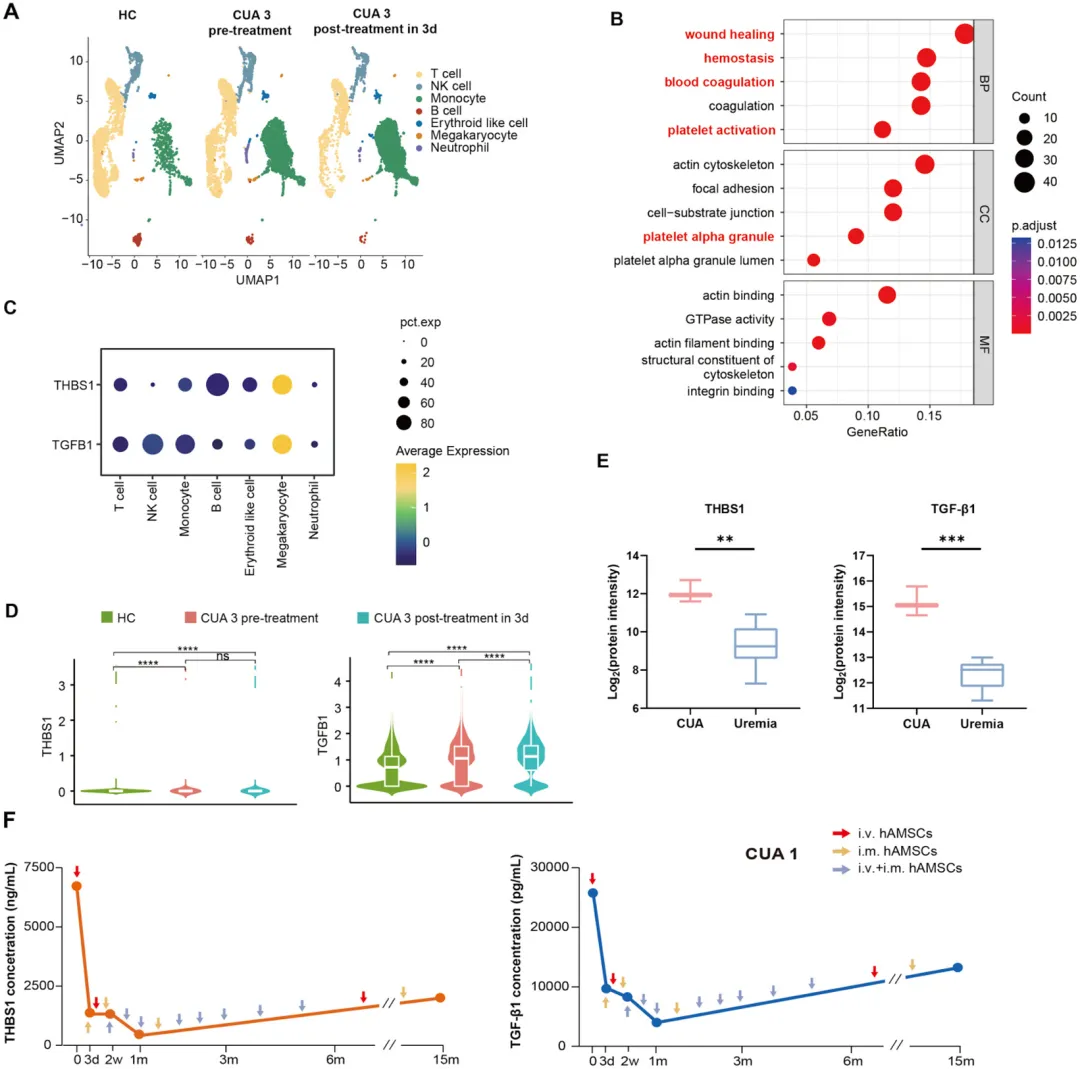
图6. 单细胞转录组测序揭示CUA患者中THBS1和TGFB1的来源及其在发现队列中的血浆水平
在验证队列中,CUA组(n=7)的血浆THBS1/TGF-β1水平高于尿毒症组(n=20),曲线下面积(Area Under the Curve,AUC)值分别为1和0.986。这些水平在hAMSC治疗三天后可以得到抑制(图7A-7B)。与健康对照相比,CUA皮肤中THBS1及其受体CD47增加(图7C-7L)。
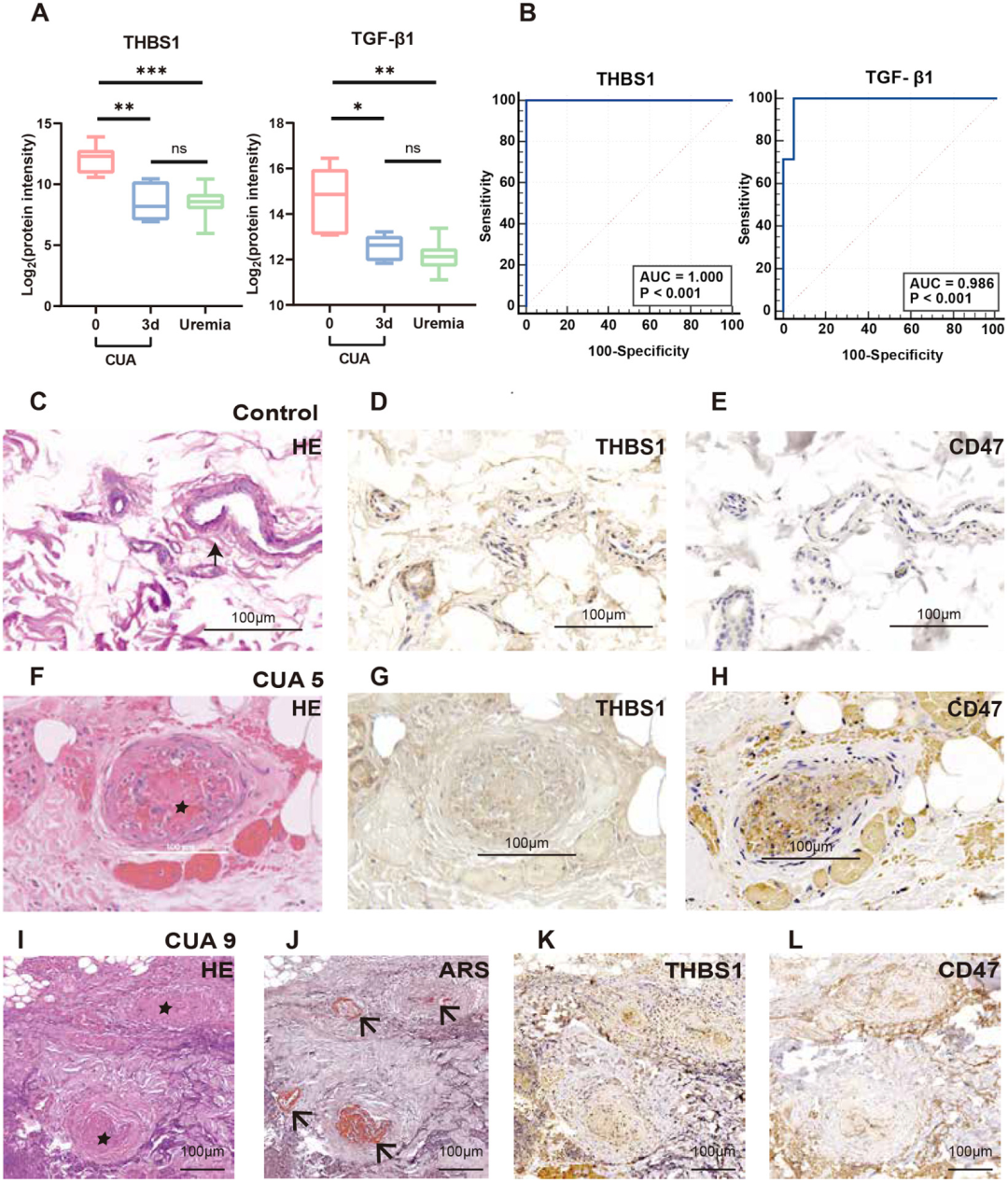
图7. 独立验证队列的生物学实验
结论
血浆THBS1和TGF-β1是CUA患者的生物标志物候选分子。个性化hAMSC策略包括静脉给药,并基于定期随访期间的生物标志物水平。
