- 首页 > 正文
指南赋能,机制攻坚——聚焦IgA肾病诊疗新范式,共绘肾脏健康新蓝图(锁定指南巡讲第3站直播会议,精彩等您来)
发表时间:2026-01-28 18:16:11
编者按
2025年11月29日,在IgA肾病诊疗理念不断革新、临床需求日益迫切的背景下,“IgA肾病管理临床实践指南巡讲”第2站在北京成功举办。此次会议汇聚国内外肾脏病领域顶尖专家学者,通过指南解读、机制剖析、前沿速递与病例分享等多个环节,全方位、深层次探讨IgA肾病诊疗的最新进展与实践路径,为临床医师搭建了高效的学术交流平台,推动我国IgA肾病诊疗迈向精准化、规范化新高度。
立足指南
夯实诊疗基础,锚定规范方向
2025年IgA肾病领域两大核心指南——《2025 KDIGO IgA肾病和IgA血管炎临床实践管理指南》[1]与《中国成人IgA肾病及IgA血管炎临床实践指南(2025)》[2]先后发布,构建了更精准的诊疗体系,同时也明确了临床仍需探索的关键方向。
(一)2025版KDIGO指南的突破性进展
指南明确肾活检是唯一确诊手段,建议蛋白尿≥0.5 g/d(或同等水平)、疑似IgA肾病且无肾活检禁忌证的成年人,应尽早肾活检。在风险评估方面,引入国际IgA肾病预测工具,整合肾活检结果、估算的肾小球滤过率(eGFR)、蛋白尿等指标,提升进展风险预判准确性。
治疗阈值被设定为蛋白尿≥0.5 g/d,核心治疗目标则明确为eGFR年下降率<1 ml/min/1.73㎡、蛋白尿<0.5 g/d(<0.3 g/d更理想)。指南首次创新性提出“双轨管理”理念:一方面针对免疫性因素,如阻止致病性IgA及IgA免疫复合物(IgA-IC)形成、减轻IgA-IC介导的肾脏损伤;另一方面,同步管理继发于免疫异常的慢性肾脏病(CKD)病程。其中,布地奈德肠溶胶囊是目前唯一推荐的对因治疗药物。
此外,指南强调多靶点同步干预策略,同时兼顾免疫炎症、CKD一般驱动因素及心血管风险,为患者提供全方位的管理方案。针对特殊人群,指南也给出了差异化建议:日本患者可考虑扁桃体切除术,中国患者则可选用吗替麦考酚酯、羟氯喹等药物,以减轻IgA/IgA-IC介导的肾脏损伤。
(二)中国指南的本土特色优化
针对中国患者发病率高、进展快、15年肾脏存活率仅40%的现状[3],中国指南在遵循国际标准基础上,形成更贴合本土临床的分层分阶段干预策略:
大多数进展性患者(蛋白尿≥0.5 g/d)需在支持治疗基础上同时启动抗炎及对因治疗;
进展风险较低的患者(蛋白尿控制在0.5 g/d以内)可先予充分支持治疗,后续蛋白尿不能维持在0.5 g/d以下,或者在长期的随访过程中蛋白尿超过0.5 g/d,则需重新评估是否存在进展风险,进而考虑启动抗炎或对因治疗。
此外,对于存在进展风险的患者,分阶段治疗应包括诱导缓解及维持治疗,除诱导阶段力求蛋白尿缓解外,所有经免疫抗炎治疗达标的患者需采用安全有效的免疫维持方案,以实现eGFR年下降率<1 ml/min/1.73㎡的长期目标。通过早期精准诊断、规范分层治疗及长期治疗,为中国IgA肾病患者提供全方位诊疗框架。
追本溯源
解析发病机制,聚焦前沿实践
(一)疾病负担与核心机制
在中国,39.73%的原发性肾小球肾炎患者经肾活检确诊为IgA肾病,南方患病率高于北方[4]。该疾病早期症状隐匿,《中国IgA肾病患者诊疗现状蓝皮书》指出,87%的患者虽有尿液异常等表现,但易被忽视,75%的患者存在就医延误的情况[5],肾脏“沉默”特性进一步加剧诊断延迟的问题。
IgA肾病的发病核心是“四重打击”学说:肠道相关淋巴组织(GALT)等黏膜部位的B细胞产生半乳糖缺陷型IgA1(Gd-IgA1);Gd-IgA1水平升高并进入体循环;产生针对Gd-IgA1的IgA和IgG自身抗体;形成含有Gd-IgA1的免疫复合物;IgA-IC沉积肾小球激活补体,最终导致肾损伤,甚至肾衰竭。
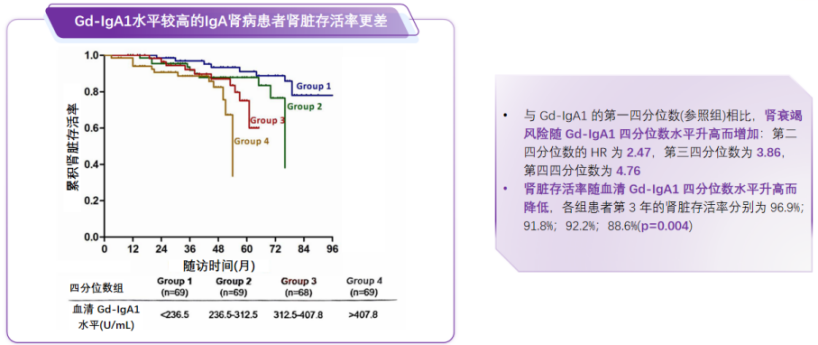
其中,Gd-IgA1是IgA肾病发病的关键分子,其循环水平与患者肾脏预后密切相关,水平越高,肾脏存活率越低[6](图1)。肠道黏膜派尔集合淋巴结是产生Gd-IgA1的重要场所[7],肠道微生物如埃希氏菌-志贺氏菌与血浆Gd-IgA1水平强相关,可能诱发Gd-IgA1产生[8]。全基因组关联研究证实[9],肠道黏膜免疫异常与IgA肾病发病密切相关,为靶向治疗提供了明确靶点。此外,多项研究发现[10-12],“四重打击”各环节中的多种生物标志物,如血清IgG自身抗体、IgA/IgG-IC水平、肾小球补体系统沉积物,与IgA肾病不良预后密切相关。
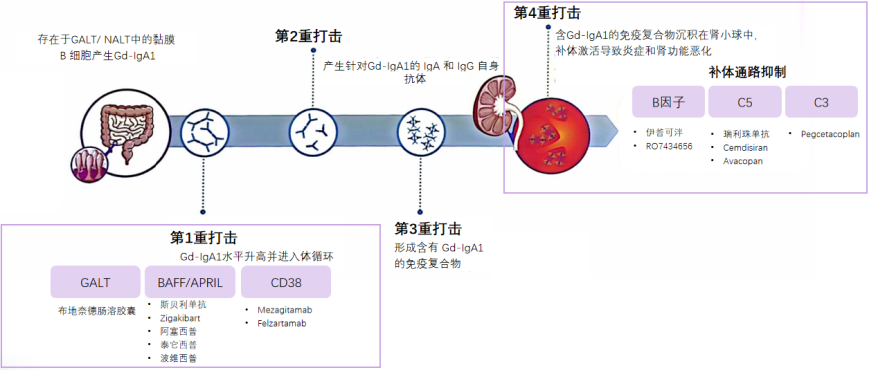
随着对发病机制的深入解析和创新药物的不断涌现,IgA肾病诊疗已迈入精准靶向时代。目前药物开发主要聚焦于“第一重打击”和“第四重打击”环节(图2)。布地奈德肠溶胶囊可精准靶向回肠末端派尔集合淋巴结,通过抑制BAFF/APRIL水平,降低Gd-IgA1及免疫复合物水平,还能特异性抑制补体系统中的旁路途径,对IgA肾病“四重打击”的各个环节均能发挥阻断作用[13-16]。此外,BAFF/APRIL抑制剂(如泰它西普、阿塞西普、斯贝利单抗等)、C38靶向治疗药物(如Felzartamab)、补体抑制剂(如伊普可泮、瑞利珠单抗等),分别作用于“第一重打击”和“第四重打击”环节。
(二)前沿研究与药物进展
2025年美国肾脏病学会(ASN)年会公布多项IgA肾病研究进展,聚焦疾病诊疗现状、潜在靶点与创新药物,为临床实践带来新启示。
在中国,超七成患者诊断时已存在进行性肾功能减退风险,且49.3%患者诊断后30天内未接受治疗或支持治疗,创新药物使用率仅13%[17]。欧洲也存在治疗目标与临床现状的差距,仅25%患者达到尿蛋白肌酐比值(UPCR)≤0.5 g/d的目标,72%患者处于CKD 3~4期[18]。
创新药物研究成果丰硕。布地奈德肠溶胶囊是2025年KDIGO和中国指南均推荐的首选对因治疗用药,已获得国家药品监督管理局(NMPA)的批准,在NefIgArd Ⅲ期研究中表现优异:72%患者维持UPCR应答≥9个月,34.6%实现UPCR≤0.5 g/g[19,20],且对于蛋白尿<0.5 g/d但存在肾功能受损的患者(该人群在NefIgArd等临床试验中未获充分研究),布地奈德肠溶胶囊治疗期间能增加部分患者eGFR水平,并维持其稳定[21]。
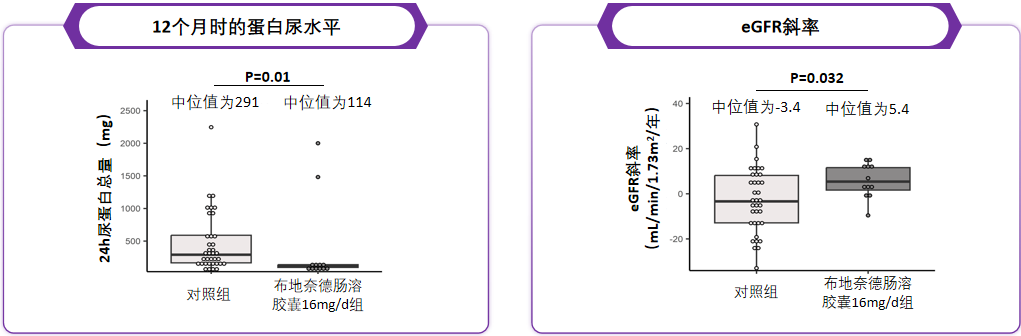
澳门镜湖医院的一项真实世界研究同样证实了布地奈德肠溶胶囊的疗效[22]:持续治疗12个月后,患者24小时尿蛋白水平从1016 mg显著降至114 mg(P=0.037),蛋白尿完全缓解,且显著低于对照组(P=0.01);患者eGFR斜率升高5.4 ml/min/1.73㎡/年,显著优于对照组(P=0.032)(图3)。这为IgA肾病的长期免疫维持治疗提供了重要依据。
此外,在ASN年会上公布的BAFF/APRIL抑制剂、补体抑制剂、内皮素受体拮抗剂等Ⅲ期研究均显示显著降蛋白尿效果。
病例分享
立足临床实际,碰撞诊疗智慧
病例一
37岁男性,尿检异常3年,肾功能异常1年余,诊断延误长达3年,确诊时已处于CKD 3期,牛津分型M1E0S0T1C1。在RAS阻断剂、羟氯喹等治疗基础上,加用布地奈德肠溶胶囊治疗5个月后,血肌酐(138.3→112 μmol/L)、eGFR(55.72→71.91 ml/min/1.73㎡)、24小时尿蛋白(1.86→1.4 g/d)、血尿(128.5→6.5/μL)等指标均显著改善。
病例二
19岁男性,泡沫尿半月余,及时行肾穿刺确诊IgA肾病(M1E0S0T0C1)。启用布地奈德肠溶胶囊联合支持治疗5个月后,镜下红细胞数量(40.1→7.7/μL)显著降低,尿蛋白完全缓解(2.11→0.31 g/d),eGFR在正常范围且维持稳定。
病例三
34岁女性,以显著镜下血尿和蛋白尿为突出表现,确诊后(M1E0S0T0C0)及时启用布地奈德肠溶胶囊联合支持治疗7个月后,尿蛋白完全缓解(0.82→0.21 g/d),eGFR维持稳定,血尿显著改善。减量后,患者血尿出现反弹。
病例四
63岁男性,合并2型糖尿病,起病急骤,表现为重度血尿、大量蛋白尿及急性肾功能损害。初始采用激素联合环磷酰胺治疗后陆续停用,转为布地奈德肠溶胶囊治疗3个月后,病情逐渐稳定,尿蛋白完全缓解(0.41→0.15 g/d),eGFR逐步回升(38.06→44.92 ml/min/1.73㎡),血尿显著改善(284.9→161.1/μL)。减量过程中,患者血尿出现反弹。
综上,布地奈德肠溶胶囊作为IgA肾病标准对因治疗药物,在不同病程、基线蛋白尿、eGFR人群中均能有效降低蛋白尿、改善肾功能、改善血尿。同时,病例也强调了足量治疗的重要性,需避免在疾病活动期随意减量导致病情反弹。
总结与展望
本次研讨会通过多维度、多视角的学术交流,全面展现了IgA肾病诊疗领域的最新进展,为临床医师提供了系统的知识更新和实践指导。IgA肾病诊疗应坚持“早诊早治”原则,重视肾穿刺活检在诊断和预后评估中的核心作用;治疗需遵循分层治疗和分阶段治疗理念,对有肾病进展风险的患者应积极对因治疗(如布地奈德肠溶胶囊);临床实践中应关注患者个体差异,制定个体化治疗方案,同时重视长期维持治疗,以达到延缓肾功能进展的终极目标。
随着对IgA肾病发病机制的深入探索和创新药物的不断涌现,诊疗模式正从经验性干预转向基于发病机制的分层精准干预。未来需加强临床研究与真实世界数据积累,优化治疗方案,提高创新药物可及性,加强患者教育,持续提升我国IgA肾病诊疗水平,为患者带来更优质的医疗服务。
参考文献
2025年11月29日,在IgA肾病诊疗理念不断革新、临床需求日益迫切的背景下,“IgA肾病管理临床实践指南巡讲”第2站在北京成功举办。此次会议汇聚国内外肾脏病领域顶尖专家学者,通过指南解读、机制剖析、前沿速递与病例分享等多个环节,全方位、深层次探讨IgA肾病诊疗的最新进展与实践路径,为临床医师搭建了高效的学术交流平台,推动我国IgA肾病诊疗迈向精准化、规范化新高度。
立足指南
夯实诊疗基础,锚定规范方向
2025年IgA肾病领域两大核心指南——《2025 KDIGO IgA肾病和IgA血管炎临床实践管理指南》[1]与《中国成人IgA肾病及IgA血管炎临床实践指南(2025)》[2]先后发布,构建了更精准的诊疗体系,同时也明确了临床仍需探索的关键方向。
(一)2025版KDIGO指南的突破性进展
指南明确肾活检是唯一确诊手段,建议蛋白尿≥0.5 g/d(或同等水平)、疑似IgA肾病且无肾活检禁忌证的成年人,应尽早肾活检。在风险评估方面,引入国际IgA肾病预测工具,整合肾活检结果、估算的肾小球滤过率(eGFR)、蛋白尿等指标,提升进展风险预判准确性。
治疗阈值被设定为蛋白尿≥0.5 g/d,核心治疗目标则明确为eGFR年下降率<1 ml/min/1.73㎡、蛋白尿<0.5 g/d(<0.3 g/d更理想)。指南首次创新性提出“双轨管理”理念:一方面针对免疫性因素,如阻止致病性IgA及IgA免疫复合物(IgA-IC)形成、减轻IgA-IC介导的肾脏损伤;另一方面,同步管理继发于免疫异常的慢性肾脏病(CKD)病程。其中,布地奈德肠溶胶囊是目前唯一推荐的对因治疗药物。
此外,指南强调多靶点同步干预策略,同时兼顾免疫炎症、CKD一般驱动因素及心血管风险,为患者提供全方位的管理方案。针对特殊人群,指南也给出了差异化建议:日本患者可考虑扁桃体切除术,中国患者则可选用吗替麦考酚酯、羟氯喹等药物,以减轻IgA/IgA-IC介导的肾脏损伤。
(二)中国指南的本土特色优化
针对中国患者发病率高、进展快、15年肾脏存活率仅40%的现状[3],中国指南在遵循国际标准基础上,形成更贴合本土临床的分层分阶段干预策略:
大多数进展性患者(蛋白尿≥0.5 g/d)需在支持治疗基础上同时启动抗炎及对因治疗;
进展风险较低的患者(蛋白尿控制在0.5 g/d以内)可先予充分支持治疗,后续蛋白尿不能维持在0.5 g/d以下,或者在长期的随访过程中蛋白尿超过0.5 g/d,则需重新评估是否存在进展风险,进而考虑启动抗炎或对因治疗。
此外,对于存在进展风险的患者,分阶段治疗应包括诱导缓解及维持治疗,除诱导阶段力求蛋白尿缓解外,所有经免疫抗炎治疗达标的患者需采用安全有效的免疫维持方案,以实现eGFR年下降率<1 ml/min/1.73㎡的长期目标。通过早期精准诊断、规范分层治疗及长期治疗,为中国IgA肾病患者提供全方位诊疗框架。
追本溯源
解析发病机制,聚焦前沿实践
(一)疾病负担与核心机制
在中国,39.73%的原发性肾小球肾炎患者经肾活检确诊为IgA肾病,南方患病率高于北方[4]。该疾病早期症状隐匿,《中国IgA肾病患者诊疗现状蓝皮书》指出,87%的患者虽有尿液异常等表现,但易被忽视,75%的患者存在就医延误的情况[5],肾脏“沉默”特性进一步加剧诊断延迟的问题。
IgA肾病的发病核心是“四重打击”学说:肠道相关淋巴组织(GALT)等黏膜部位的B细胞产生半乳糖缺陷型IgA1(Gd-IgA1);Gd-IgA1水平升高并进入体循环;产生针对Gd-IgA1的IgA和IgG自身抗体;形成含有Gd-IgA1的免疫复合物;IgA-IC沉积肾小球激活补体,最终导致肾损伤,甚至肾衰竭。
其中,Gd-IgA1是IgA肾病发病的关键分子,其循环水平与患者肾脏预后密切相关,水平越高,肾脏存活率越低[6](图1)。肠道黏膜派尔集合淋巴结是产生Gd-IgA1的重要场所[7],肠道微生物如埃希氏菌-志贺氏菌与血浆Gd-IgA1水平强相关,可能诱发Gd-IgA1产生[8]。全基因组关联研究证实[9],肠道黏膜免疫异常与IgA肾病发病密切相关,为靶向治疗提供了明确靶点。此外,多项研究发现[10-12],“四重打击”各环节中的多种生物标志物,如血清IgG自身抗体、IgA/IgG-IC水平、肾小球补体系统沉积物,与IgA肾病不良预后密切相关。
随着对发病机制的深入解析和创新药物的不断涌现,IgA肾病诊疗已迈入精准靶向时代。目前药物开发主要聚焦于“第一重打击”和“第四重打击”环节(图2)。布地奈德肠溶胶囊可精准靶向回肠末端派尔集合淋巴结,通过抑制BAFF/APRIL水平,降低Gd-IgA1及免疫复合物水平,还能特异性抑制补体系统中的旁路途径,对IgA肾病“四重打击”的各个环节均能发挥阻断作用[13-16]。此外,BAFF/APRIL抑制剂(如泰它西普、阿塞西普、斯贝利单抗等)、C38靶向治疗药物(如Felzartamab)、补体抑制剂(如伊普可泮、瑞利珠单抗等),分别作用于“第一重打击”和“第四重打击”环节。
(二)前沿研究与药物进展
2025年美国肾脏病学会(ASN)年会公布多项IgA肾病研究进展,聚焦疾病诊疗现状、潜在靶点与创新药物,为临床实践带来新启示。
在中国,超七成患者诊断时已存在进行性肾功能减退风险,且49.3%患者诊断后30天内未接受治疗或支持治疗,创新药物使用率仅13%[17]。欧洲也存在治疗目标与临床现状的差距,仅25%患者达到尿蛋白肌酐比值(UPCR)≤0.5 g/d的目标,72%患者处于CKD 3~4期[18]。
创新药物研究成果丰硕。布地奈德肠溶胶囊是2025年KDIGO和中国指南均推荐的首选对因治疗用药,已获得国家药品监督管理局(NMPA)的批准,在NefIgArd Ⅲ期研究中表现优异:72%患者维持UPCR应答≥9个月,34.6%实现UPCR≤0.5 g/g[19,20],且对于蛋白尿<0.5 g/d但存在肾功能受损的患者(该人群在NefIgArd等临床试验中未获充分研究),布地奈德肠溶胶囊治疗期间能增加部分患者eGFR水平,并维持其稳定[21]。
澳门镜湖医院的一项真实世界研究同样证实了布地奈德肠溶胶囊的疗效[22]:持续治疗12个月后,患者24小时尿蛋白水平从1016 mg显著降至114 mg(P=0.037),蛋白尿完全缓解,且显著低于对照组(P=0.01);患者eGFR斜率升高5.4 ml/min/1.73㎡/年,显著优于对照组(P=0.032)(图3)。这为IgA肾病的长期免疫维持治疗提供了重要依据。
此外,在ASN年会上公布的BAFF/APRIL抑制剂、补体抑制剂、内皮素受体拮抗剂等Ⅲ期研究均显示显著降蛋白尿效果。
病例分享
立足临床实际,碰撞诊疗智慧
病例一
37岁男性,尿检异常3年,肾功能异常1年余,诊断延误长达3年,确诊时已处于CKD 3期,牛津分型M1E0S0T1C1。在RAS阻断剂、羟氯喹等治疗基础上,加用布地奈德肠溶胶囊治疗5个月后,血肌酐(138.3→112 μmol/L)、eGFR(55.72→71.91 ml/min/1.73㎡)、24小时尿蛋白(1.86→1.4 g/d)、血尿(128.5→6.5/μL)等指标均显著改善。
病例二
19岁男性,泡沫尿半月余,及时行肾穿刺确诊IgA肾病(M1E0S0T0C1)。启用布地奈德肠溶胶囊联合支持治疗5个月后,镜下红细胞数量(40.1→7.7/μL)显著降低,尿蛋白完全缓解(2.11→0.31 g/d),eGFR在正常范围且维持稳定。
病例三
34岁女性,以显著镜下血尿和蛋白尿为突出表现,确诊后(M1E0S0T0C0)及时启用布地奈德肠溶胶囊联合支持治疗7个月后,尿蛋白完全缓解(0.82→0.21 g/d),eGFR维持稳定,血尿显著改善。减量后,患者血尿出现反弹。
病例四
63岁男性,合并2型糖尿病,起病急骤,表现为重度血尿、大量蛋白尿及急性肾功能损害。初始采用激素联合环磷酰胺治疗后陆续停用,转为布地奈德肠溶胶囊治疗3个月后,病情逐渐稳定,尿蛋白完全缓解(0.41→0.15 g/d),eGFR逐步回升(38.06→44.92 ml/min/1.73㎡),血尿显著改善(284.9→161.1/μL)。减量过程中,患者血尿出现反弹。
综上,布地奈德肠溶胶囊作为IgA肾病标准对因治疗药物,在不同病程、基线蛋白尿、eGFR人群中均能有效降低蛋白尿、改善肾功能、改善血尿。同时,病例也强调了足量治疗的重要性,需避免在疾病活动期随意减量导致病情反弹。
总结与展望
本次研讨会通过多维度、多视角的学术交流,全面展现了IgA肾病诊疗领域的最新进展,为临床医师提供了系统的知识更新和实践指导。IgA肾病诊疗应坚持“早诊早治”原则,重视肾穿刺活检在诊断和预后评估中的核心作用;治疗需遵循分层治疗和分阶段治疗理念,对有肾病进展风险的患者应积极对因治疗(如布地奈德肠溶胶囊);临床实践中应关注患者个体差异,制定个体化治疗方案,同时重视长期维持治疗,以达到延缓肾功能进展的终极目标。
随着对IgA肾病发病机制的深入探索和创新药物的不断涌现,诊疗模式正从经验性干预转向基于发病机制的分层精准干预。未来需加强临床研究与真实世界数据积累,优化治疗方案,提高创新药物可及性,加强患者教育,持续提升我国IgA肾病诊疗水平,为患者带来更优质的医疗服务。
参考文献
1. KidneyInternational.2025;108(Suppl4S):S1-S71.
2. 中国IgA肾病协作组(IIgANN-China)科学委员会,等.中华内科杂志.2025;64(10):918-944.
3. ShenX,etal.NephrolDialTransplant.2024; Nov19:gfae252.
4. Xu L, et al. J Nephrol. 2025 Jul;38(6):1557-1564.
5. 中国 IgA 肾病患者诊疗现状蓝皮书
6. Zhao N, et al. Kidney Int. 2012;82:790-796.
7. Barratt J, et al. Kidney Int Rep. 2020 Aug 20;5(10):1620-1624.
8. Gao L, et al. Front Immunol. 2024 Jul 22;15:1415026.
9. Kiryluk K, et al. Nat Genet. 2014;46(11):1187-1196.
10. Berthoux F, et al. J Am Soc Nephrol. 2012;23:1579-1587.
11. Suzuki Y, et al. Clin Exp Nephrol. 2014;18:770-777.
12. Medjeral-Thomas NR, et al. Kidney Int Rep. 2017 Nov 29;3(2):426-438.
13. Nadia Nawaz, et al. 2023 IIgANN. Analysis of the NefIgArd Part A study population confirms Nefecon suppresses circulating levels of BAFF, APRIL, and soluble BCMA in IgA nephropathy.
14. Ishika Khan, et al. Effects of nefecon on Hits 1, 2, and 3 of the pathogenic cascade of IgA nephropathy: a full NefIgArd analysis of exploratory biomarkers. 2025 IIgANN.
15. Thomas RC, et al. ASN 2024. Abstract:FR-PO894.
16. Nawaz N, et al. ASN 2024. Abstract:FR-PO859.
17. Nan OY, et al. ASN 2025. Abstract. SA-PO0846.
18. Csomor Philipp, et al. 2025 ASN Abstract SA-PO0795.
19. Rovin B, et al. ASN 2025. Abstract: SA-OR047.
20. Reich Heather N., et al. ASN 2025. Abstract: FR-PO0804.
21. Dong L, et al. ASN 2025. Abstract. SA-PO0842.
22. Xia L, et al. ASN 2025. Abstract. SA-PO0824.
- 推荐文章
肾识百科|“狼”疮妈妈的“孕”筹帷幄:7问7答囊括狼疮肾炎与妊娠的那些事儿
肾例明鉴|高复发率、复杂性,让肾脏科医师头疼!一例难治性微小病变肾病诊治经验分享
新型质谱技术显著提升PLA2R阴性MN的抗原检出率,为MN的精准诊断、病因探寻及个体化治疗提供坚实技术支撑
重磅丨泰它西普在中国IgA肾病Ⅲ期临床研究中取得突破性进展
儿童罕见肾脏病——让孩子年轻轻轻就得肾结石,元凶多是这种肾脏遗传病
房中则教授:肠道菌群——代谢性疾病防治的新靶点与新策略
最新资讯|全球首个膜性肾病特异性治疗药物Felzartamab的Ⅲ期临床试验PROMINENT正式启动
尿液KIM-1、MCP-1及EGF可作为糖尿病肾病进展的独立预测因子:基于CRIC研究的病例队列分析
CSE 2025 | 洪天配教授:GLP-1受体激动剂对胰岛β细胞的影响:改善功能还是延缓衰竭?
CNA2025|张爱华教授:运动因子在CKD血管钙化调控中的作用机制探讨
诺锐达®(盐酸阿曲生坦片)在中国获批IgA肾病适应证,成为国内首个针对该疾病的非免疫性疗法
9.9%白蛋白尿进展,32.5%肾功能恶化!北京医院郭立新、潘琦教授团队揭示T2DM患者DKD进展轨迹
重新构想SGLT2i:拓展其在心血管-肾脏-代谢及更多领域的新用途
CNA 2025 | IgA肾病治疗策略迎革命性转变,APRIL抑制剂——斯贝利单抗成开路先锋
陈孟华教授:腹膜透析患者营养不良的评估与管理
肾例明鉴 | 原发性干燥综合征合并冷球蛋白血症性肾小球肾炎伴非弥漫性膜增生性肾小球肾炎样病变一例
血清阴性≠排除狼疮肾炎!一例特殊病例的诊断与治疗突破 图片 点击蓝字 关注我们
"磷"危时刻——李贵森教授带你了解透析患者高磷血症管理策略与临床新进展
TESTING研究事后分析:激素治疗可改善高进展风险IgA肾病的肾脏结局,无论基线蛋白尿或eGFR如何
ACC/AHA等十余家学术机构联合发布新高血压指南,强调预防、尽早治疗以降低心血管疾病风险
CKD患者血压管理的破局之道——许钟镐教授详解临床“秘籍”
肾域华章 | 上海曙光医院课题组揭示中药复方仙黄方抗肾间质纤维化的分子机制!
病例分享 | 两大“健康杀手”协同攻击,如何打破心肾恶性循环?一例4型心肾综合征的诊治启示
破局“肾”痒!思舒静®(安瑞克芬注射液)Ⅲ期数据登顶国际顶刊《BMJ》!
从CKM到CLKM——郑明华/周晓东教授nature reviews:cardiology发文,呼吁将肝脏正式纳入整合管理框架
醛固酮靶向治疗:在难治性高血压与慢性肾脏病中实现早期干预的新范式
非奈利酮用于CKD合并T2DM治疗的作用机制和循证回顾
指南共识 | 2025肾脏移植受者术后切口并发症临床诊疗指南,14大临床问题28条解决方案!
肾研药讯丨FDA批准两款蔗糖铁注射液仿制药用于慢性肾脏病相关缺铁性贫血治疗
CNA2025|赵建荣教授:IgA肾病中西医结合治疗的现状、机制与发展方向
CNA2025|魏佳莉教授:继发性IgA肾病九大病因解析
CNA2025|周晓玲教授:乙肝相关性肾炎诊治进展
肾例明鉴|警惕,这个病毒近期高发!流感季里肆虐的甲流,让不少人的肾脏不堪重负
关于GLP-1RA的最大误解:心肾获益来源于减重?
靶向炎症和纤维化:T2DM相关CKD患者早期优化治疗策略
儿童、成人、老人,谁的肾脏在狼疮肾炎中更“扛造”?数据告诉你真相
征文投稿倒计时30天 | 中华医学会肾脏病学分会第二十八届学术年会
CNA2025|丁峰教授:从尿毒症毒素看充分性血液透析的前沿策略
KI杂志重磅公布:eGFR急性下降很慌?FIDELITY汇总分析证实非奈利酮的心肾获益根本不受它的影响
病例分享 | 年轻女性突发恶性高血压,警惕沉默的血压“操控者”——肾动脉纤维肌性发育不良
CNA2025|许冬梅教授:膜性肾病发病机制研究进展
CKJ重磅公布:内皮素受体拮抗剂首个荟萃分析证实其显著降低IgA肾病患者蛋白尿、血压
关于举办2025年肾脏病研究进展南方论坛暨医疗大数据论坛的通知
ERA发布IgAN突破性疗法:斯贝利单抗III期中期分析结果振奋人心,IgAN患者uPCR-24h显著降低51.2%
CKJ丨系统性红斑狼疮肾炎(LN)管理的十大建议
JAMA公布Launch-HTN临床试验结果:醛固酮合成酶抑制剂治疗高血压
CNA2025|涂晓文教授:中晚期糖尿病肾脏疾病临床关注问题解析
医生,我周末才运动,行吗?一项基于5万余例糖尿病患者的研究给出肯定答案!
CNA2025|陈香美院士开幕引航,开启肾病防治数智新征程
从机制到临床:一文读懂非奈利酮在CKM综合征中的最新证据
肾例明鉴丨男子烫伤后肾损伤严重,肾脏竟出现100%新月体,为何让医生直呼意想不到?
狼疮肾炎还是继发性膜性肾病?从诊断困境到乙肝相关性肾炎治疗新进展
征文通知 | 中华医学会肾脏病学分会第二十八届学术年会
RNA疗法在肾脏疾病中的应用前景与现状
Zigakibart在IgA肾病治疗中的临床价值:基于Ⅰ/Ⅱ期研究的多维度分析
