- 首页 > 正文
CCSN 2025|韩飞教授:生物制剂治疗狼疮性肾炎的进展与思考
发表时间:2026-01-30 14:58:36
编者按
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)最严重的并发症之一,对患者的预后和生活质量产生了重大影响。近年来,生物制剂的出现为LN的治疗带来了新的希望。生物制剂通过靶向特定的免疫细胞或分子,调节免疫反应,从而减轻肾脏炎症和损伤。2023年EULAR指南与2024年KDIGO指南共同确立了生物制剂在LN治疗中的重要地位。在中华医学会肾脏病学分会第二十八届学术年会(CCSN 2025)上,浙江大学医学院附属第一医院韩飞教授深入阐述了生物制剂治疗LN的最新进展,为临床实践提供了重要参考。


韩飞 教授浙江大学医学院附属第一医院
博士,教授、主任医师,博士生导师
浙江大学附属第一医院肾脏病中心副主任、内科教研室副主任、肾脏病教研室主任
入选浙江省医疗卫生领军人才计划
中华医学会肾脏病学分会委员
中国研究型医院学会肾脏病学专业委员会常务委员
浙江省医师协会肾脏内科医师分会会长
浙江省医学会肾脏病分会常务委员浙江省生物医学工程学会副理事长
主持国家自然科学基金5项,国家重点研发项目子课题、浙江省重点研发项目、省自然科学基金重点项目等7项。已发表SCI期刊论文100余篇,包括Kidney International,Advanced Science,Theranostics,Hypertension等责任通讯论著。主参课题获得浙江省科技进步一等奖2项。
一、SLE/LN的生物制剂治疗靶点
生物制剂的开发基于对SLE发病机制的深入理解。SLE的发病机制复杂,涉及多种免疫细胞和细胞因子的异常激活。因此,生物制剂的靶点涵盖了B细胞、T细胞、浆细胞、细胞因子及其受体等多个方面(图1)。以下是一些主要的治疗靶点及其对应的生物制剂[1]:
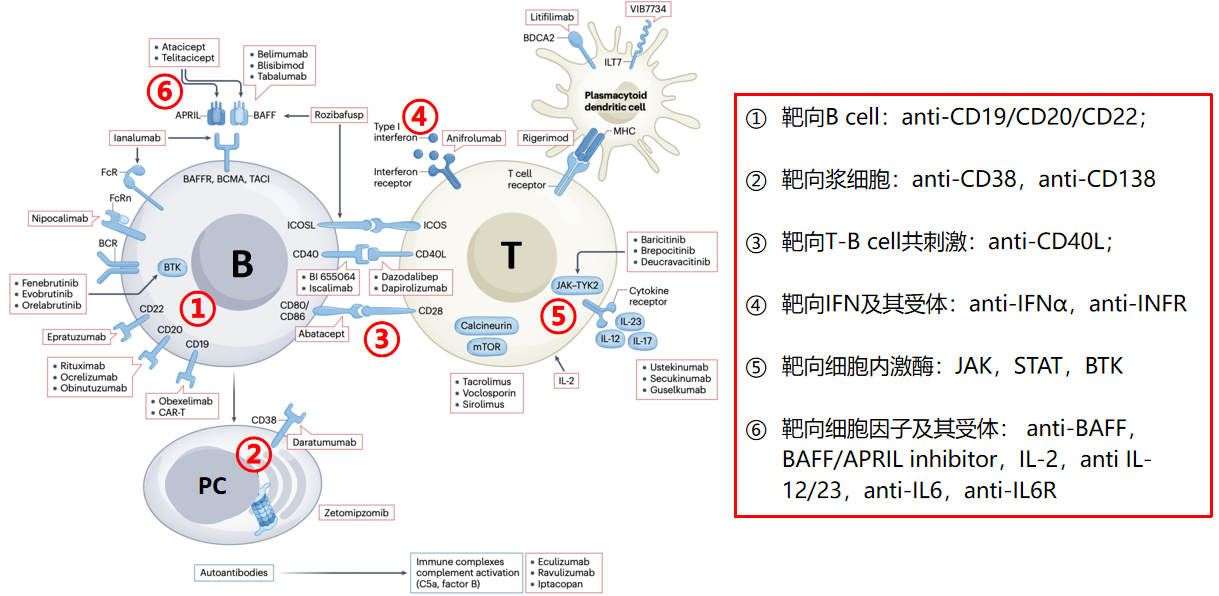
图1. SLE的生物制剂治疗靶点
(一)靶向B细胞
B细胞在SLE的发病中起着关键作用,因此B细胞靶向治疗是LN治疗的重要策略之一。常见的靶点包括CD19、CD20和CD22。利妥昔单抗(抗CD20单克隆抗体)是最早应用于LN治疗的生物制剂之一,奥妥珠单抗(三代抗CD20单克隆抗体)也显示出较好的疗效。(二)靶向浆细胞
浆细胞是产生自身抗体的主要细胞,因此靶向浆细胞也是LN治疗的一个重要方向。抗CD38和CD138单克隆抗体是目前研究的主要药物。
(三)靶向B细胞和T细胞共刺激途径
B细胞和T细胞的相互作用在SLE的发病中起着重要作用。因此,靶向CD40L(T-B细胞共刺激途径)的生物制剂如Dapirolizumab pegol也在研究中。然而,最近的一项Ⅱ期试验显示,Dapirolizumab pegol未能达到主要终点。
(四)靶向细胞因子及其受体
细胞因子在SLE的发病中起着关键作用,因此靶向细胞因子及其受体的生物制剂也是LN治疗的重要方向。例如,贝利尤单抗(抗BAFF单克隆抗体)在BLISS-52和BLISS-76试验中显示出对SLE患者的疗效;在BLISS-LN试验中,贝利尤单抗+标准诱导治疗活动性LN患者的肾脏反应优于安慰剂。此外,他贝芦单抗(抗可溶性和膜结合BAFF的人源化单克隆抗体)、阿他西普(TACI与部分IgG Fc融合蛋白)和泰它西普(新型重组TACI-Fc融合蛋白)也在研究中。
(五)靶向细胞内激酶
细胞内激酶如JAK和BTK在SLE的发病中也起着重要作用。因此,靶向这些激酶的生物制剂如Tofacitinib和Baricitinib等也在研究中。
(六)靶向IFN及其受体
Anifrolumab(阿尼鲁单抗)是一种靶向I型干扰素受体的全人源单克隆抗体,TULIP 1 & 2 及其扩展研究显示其治疗SLE的结果矛盾。
二、生物制剂治疗LN的临床研究进展
CD20靶向治疗以利妥昔单抗为代表,在难治性LN治疗中积累充分证据。一项纳入31项LN和SLE研究的meta分析显示,利妥昔单抗治疗的完全缓解率为51%[2]。浙江大学医学院附属第一医院中心数据也发现在难治性LN,及合并血栓性微血管病的LN中,其联合治疗表现出显著疗效。LUNAR研究后分析中72例使用利妥昔单抗的Ⅲ/Ⅳ型LN患者数据显示,外周血B细胞完全耗竭与完全缓解率呈正相关[3,4]。
奥妥珠单抗是三代抗CD20单克隆抗体,在REGENCY Ⅲ期试验中显示优势[5]:活动性LN患者随机接受奥妥珠单抗或安慰剂联合霉酚酸酯治疗,52周时奥妥珠单抗组完全缓解率显著高于对照组,但新冠肺炎感染率较高。
BAFF/APRIL通路抑制以贝利尤单抗与泰它西普为代表。贝利尤单抗是抗BAFF单克隆抗体。EULAR 2023指南明确推荐利妥昔单抗为难治性LN的一线挽救治疗方案。KDIGO 2024指南进一步将贝利尤单抗列为增殖型LN诱导及维持治疗的1A类推荐,这一决策基于BLISS-LN Ⅲ期试验5年随访数据:贝利尤单抗联合标准治疗较安慰剂显著降低肾脏复发风险53%,并延缓估算的肾小球滤过率(eGFR)下降速率[6]。贝利尤单抗的长期肾脏保护作用,其关键机制在于持续抑制BAFF水平,阻断自身反应性B细胞活化。
值得注意的是,利妥昔单抗治疗后出现的BAFF水平反跳与复发风险增加相关。浙江大学医学院附属第一医院研究也发现,成人频繁复发/激素依赖型微小病变或局灶节段性肾小球硬化患者使用利妥昔单抗后再复发,与较高的NK细胞计数相关,而研究报道患者使用利妥昔单抗或奥妥珠单抗后,其NK细胞分泌BAFF水平显著增加。基于该原因,利妥昔单抗治疗后续贯贝利尤单抗已有CALIBATE研究、BEAT-LUPUS研究等报道有效。例如,CALIBATE研究显示,利妥昔单抗和环磷酰胺治疗后再使用贝利尤单抗,在治疗难治性LN时能够显著提高患者的缓解率[7]。BEAT-LUPUS研究显示,利妥昔单抗治疗后再使用贝利尤单抗治疗难治性SLE患者,可显著降低抗dsDNA抗体水平和重度复发风险[8]。浙江大学医学院附属第一医院研究也显示,个体化利妥昔单抗后续贯贝利尤单抗或泰它西普可有效治疗难治性LN,且续贯泰它西普者缓解率有增加趋势[9,10]。
另外,CAR-T疗法也有多个中心病例系列报道,可有效诱导难治性SLE缓解。我院的病例系列提示CD19联合BCMA双靶向CAR-T治疗可有效诱导难治性SLE缓解并降低自身抗体水平,清除致病性B细胞克隆[11]。在活跃增殖性LN中,补体靶向治疗可能快速控制组织损伤及炎症。我们的病例系列发现,依库珠单抗联合利妥昔单抗治疗急进性肾炎(包括抗GBM肾炎、LN、AAV导致者)可有效诱导缓解,且安全性可接受,为传统免疫抑制疗法受限或起效较慢的患者提供了新的治疗策略。
尽管生物制剂重塑LN治疗格局,关键问题仍需关注:(1)个体化策略制定需结合病理类型及治疗阶段;(2)疗效预测标志物缺失,亟待建立BAFF水平、B细胞亚群等预测体系;(3)长期安全性数据不足(>5年随访证据有限);(4)治疗成本可及性影响临床普及。
三、总结
生物制剂的快速发展正在重塑LN治疗格局。从利妥昔单抗、贝利尤单抗到新型双通路抑制剂及细胞疗法、补体靶向治疗,循证医学证据持续推动指南更新。未来研究需着力解决个体化治疗决策、监测标志物,长期安全性监测及卫生经济学评估等关键问题,以实现LN治疗的精准化突破。
参考文献
1. Mok, et al. nature reviews rheumatology, 2023.
2. Alshaiki F, et al. Eur J Rheumatol. 2018; 5(2): 118-126.
3. Rovin BH, et al. Arthritis Rheum. 2012 Apr; 64(4): 1215-26.
4. Gomez Mendez LM, et al. Clin J Am Soc Nephrol. 2018; 13(10): 1502-1509.
5. Furie RA, et al. N Engl J Med. 2025 Apr 17; 392(15): 1471-1483.
6. Furie R, et al. N Engl J Med. 2020
7. Atisha-Fregoso Y, et al. Arthritis Rheumatol. 2020; 10.1002.
8. Muhammad Shipa et al. Ann Intern Med. 2021
9. Chen Y, Han F. Rheumatology 2023.
10. Chen Y, Han F. Lupus Sci Med 2025.
11. Feng, J, et al.. Nat Med 2025 Sep 24.
- 推荐文章
