- 首页 > 正文
CCSN 2025|王骏教授:靶向细胞衰老阻断AKI后肾脏纤维化的新机制与新策略
发表时间:2026-01-30 15:41:16
编者按
多年来,临床普遍认为急性肾损伤(AKI)幸存者会恢复正常的肾脏结构和功能。然而,越来越多的流行病学研究证实,AKI幸存者后续发生进行性慢性肾脏病(CKD)的风险显著升高——而肾脏纤维化正是AKI向CKD进展的核心病理环节。在中华医学会肾脏病学分会第二十八届学术年会(CCSN 2025)上,南方医科大学南方医院王骏教授围绕这一科学问题,详细阐述了靶向细胞衰老,阻断AKI后肾脏纤维化的新机制与新策略。

专家简介

主任医师、博士生导师
南方医科大学南方医院肾内科
上海交通大学附属瑞金医院肾脏科博士后
国际肾脏病学会(ISN)访问学者
中国医药教育协会临床肾脏病学专业委员会常委
广东省医师协会肾脏内科医师分会委员
主持国家自然科学基金面上项目3项
发表SCI收录论文12篇
一、AKI后CKD:亟待破解的医学难题
AKI可诱导肾脏细胞衰老,而衰老则会使肾脏细胞在应对细胞应激与DNA损伤时更易发生G2/M期阻滞,进一步加剧适应不良修复。AKD阶段肾脏衰老细胞以肾小管上皮细胞为主,这类细胞会分泌多种表型因子,激活成纤维细胞并引发级联反应,最终导致肾脏纤维化[6,7]。因此,AKI后肾脏衰老被视为AKI向CKD转化的关键中间环节,靶向该环节有望成为阻断疾病进展的有效策略。
三、靶向细胞衰老:阻断AKI后肾脏纤维化的新策略
四、最新机制突破:Panx1促进肾脏衰老与纤维化
在AKI后肾脏衰老机制研究中,王骏教授团队取得突破性发现,首次系统阐明蛋白分子Pannexin1(Panx1)在驱动肾脏细胞衰老与纤维化中的作用。既往研究多关注Panx1在细胞膜上的经典功能(如ATP释放通道),对其在细胞内细胞器中的作用探索有限。研究揭示,Panx1发挥着“非经典”作用:它在内质网上作为Ca2+泄漏通道,其介导的Ca2+泄漏会扰乱线粒体功能,进而促进肾小管细胞衰老,最终驱动AKI后肾脏纤维化进程[6](图1)。
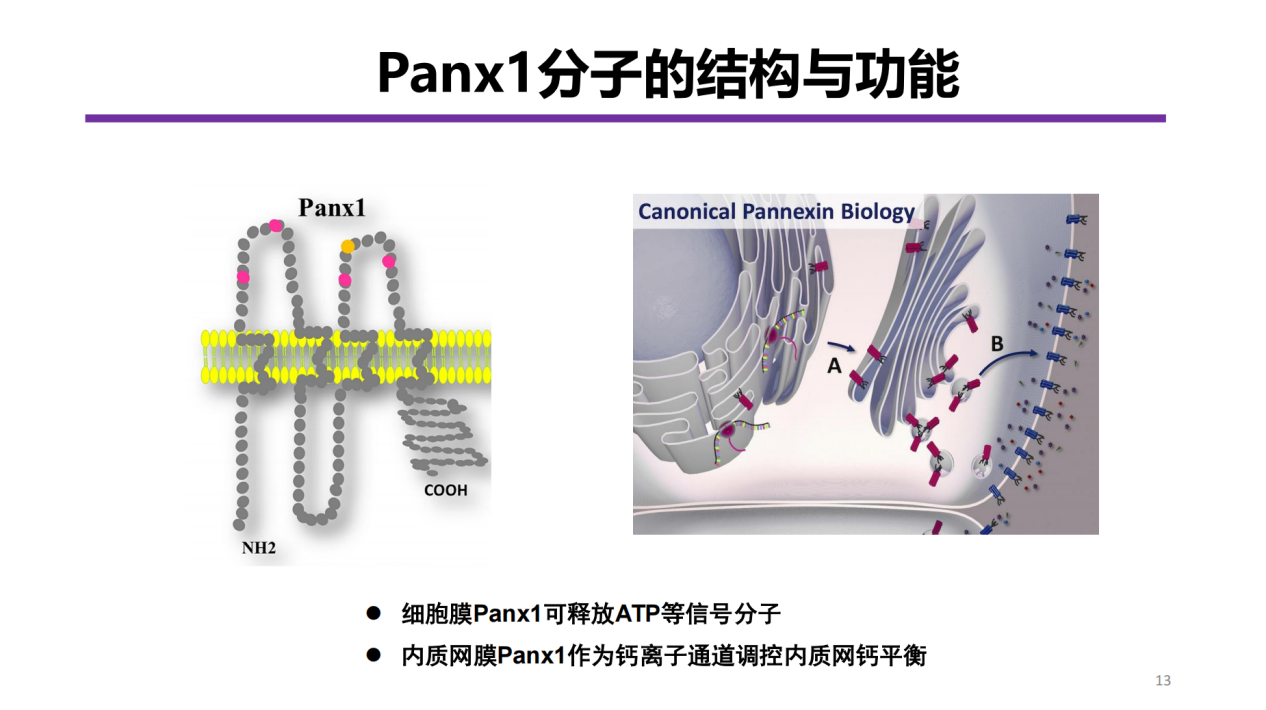
衰老过程中,Panx1并非在细胞膜发挥作用,而是在细胞内内质网异常积聚(可能与衰老诱导的蛋白错误折叠相关)。肾小管上皮细胞衰老时,内质网Panx1表达会增加。截短的内质网特异性Panx1构建体转染至Panx1敲除的肾小管上皮细胞,结果显示,截短型Panx1与内质网共定位,并诱导细胞增殖减少和衰老增加,提示内质网积聚的Panx1在应激诱导的细胞衰老中具有重要作用。
Panx1引发的Ca2+信号紊乱会进一步破坏线粒体功能。研究发现,Panx1可促进内质网Ca2+向线粒体转移,这一过程与内质网-线粒体触位点(MERCs)密切相关。上调Panx1会增加MERCs数量,促进Ca2+从内质网向线粒体异常转移,导致线粒体Ca2+超载、功能障碍,表现为膜去极化、活性氧(ROS)产生增加及细胞衰老。实验证实,阻断线粒体Ca2+流入可减轻线粒体损伤与细胞衰老;压力条件下敲除Panx1,能减少MERCs数量、减轻线粒体损伤,进而降低肾脏衰老与纤维化程度。
临床转化研究进一步验证了Panx1的临床价值,在AKD患者肾活检样本中,Panx1表达水平显著升高,且与肾小管损伤程度、细胞衰老标志物及纤维化程度呈正相关。这一结果将基础研究与临床病理特征紧密关联,证实Panx1是人类AKI向CKD转化中的关键驱动因子,同时也是潜在的治疗靶点。此外,Panx1基因敲除小鼠模型中,肾脏衰老与纤维化程度显著减轻,从反向验证了靶向Panx1治疗AKI后CKD的可行性[6]。
五、总结
参考文献
1. Kellum JA, et al. Nat Rev Dis Primers. 2021 Jul 15; 7(1): 52.
2. Chawla LS, et al. N Engl J Med. 2014;371(1):58-66.
3. Wang L, et al. JAMA Intern Med. 2023;183(4):298-310.
4. Kellum JA, et al. Nat Rev Nephrol. 2021;17(7):493-502.
5. Ferenbach DA, et al. Nat Rev Nephrol. 2015;11(5):264-276.
6. Huang L, et al. Nat Commun. 2025;16(1):7699.
7. Li C, et al. FASEB J. 2021;35(1):e21229.
8. Li C, et al. Free Radic Biol Med. 2019;130:512-527.
- 推荐文章
