- 首页 > 正文
ASN研究者说 | CKD中肾周脂肪来源间充质干细胞的衰老与成骨表型:揭示钙化微环境的新机制
发表时间:2026-01-31 09:39:36
慢性肾病(CKD)不仅累及肾脏本身,还伴随系统性血管钙化与动脉僵硬,这些改变显著增加患者心血管风险。近年来,肾周脂肪组织(PRAT)作为肾脏微环境的重要组成部分,逐渐受到关注。其分泌的细胞因子可能通过旁分泌机制影响肾血管结构和功能。
在2025年美国肾脏病学会(ASN 2025)年会上,西班牙马德里康普顿斯大学的研究人员展示了一项题为“Senescent and Osteogenic Phenotype of Perirenal Adipose-Derived Mesenchymal Stem Cells in a Rat Model of CKD”(慢性肾病大鼠模型中肾周脂肪来源间充质干细胞的衰老与成骨表型)的壁报研究(摘要号:TH-PO1182)。该研究提示,在慢性肾病状态下,肾周脂肪来源的间充质干细胞(ADMSCs)呈现出显著的衰老特征及成骨分化倾向,可能成为促钙化微环境的重要来源。肾医线现场特邀研究第一作者Elvira Bragado García博士对该研究进行解读。
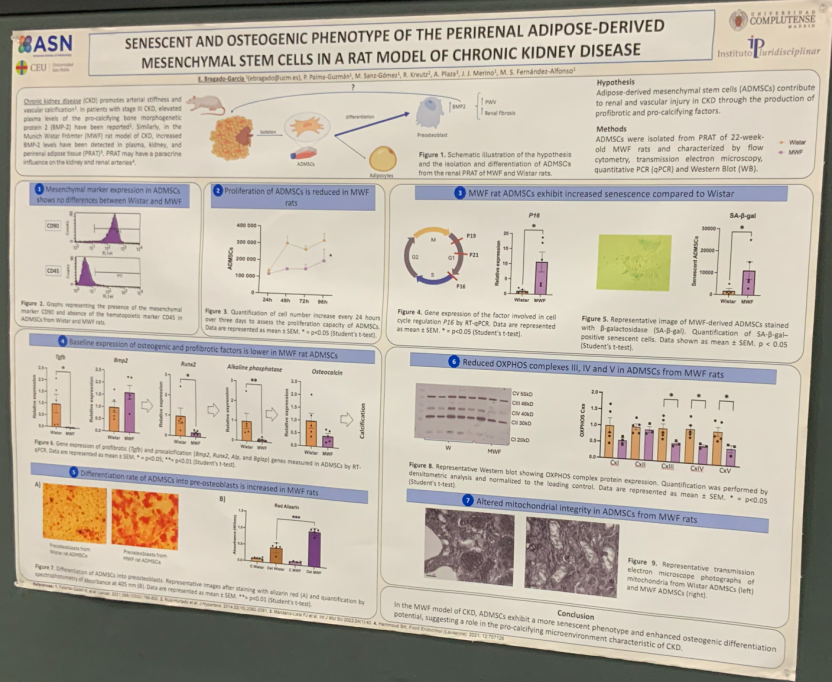
Elvira Bragado García博士介绍,我们知道慢性肾病会促进血管钙化与动脉僵硬。Munich Wistar Frömter(MWF)CKD大鼠模型与人CKD 3期特征相似)。研究团队此前发现,3期CKD患者血浆中促钙化蛋白——骨形态发生蛋白2(BMP-2)水平显著升高。同样,在常用的MWF大鼠CKD模型中,研究者也检测到血浆、肾组织及肾周脂肪组织内BMP-2水平均明显上升。这提示肾周脂肪可能不仅是“旁观者”,而是通过旁分泌信号影响肾脏和肾动脉病变的“推手”。
基于此,研究团队提出假设:肾周脂肪来源的间充质干细胞(ADMSCs)通过分泌促纤维化和促钙化因子,参与CKD相关肾脏与血管损伤的发生与进展。
二、研究方法:多层面解析ADMSCs生物学特征
研究者从22周龄的MWF大鼠及健康Wistar对照鼠的肾周脂肪组织中分离ADMSCs,并采用流式细胞术、透射电子显微镜(TEM)及实时定量PCR(qPCR)等多种技术手段进行表征。
所有来源的ADMSCs均表达间充质标志物CD90,而不表达造血标志物CD45,从而确认其细胞谱系特征。
在比较不同组别细胞的分子特征时,团队发现MWF组ADMSCs的成骨相关基因(Runx2、Alp)、脂肪分化基因(Pparγ、Lpl)及促纤维化基因(Tgfβ)的基础表达水平均低于对照组。然而,令人意外的是,当诱导成骨分化并使用茜素红染色(Alizarin Red)检测钙盐沉积后,MWF组细胞的成骨能力反而显著增强。
这一“低基因表达-高分化能力”的反常结果,引发了研究者对细胞功能状态的进一步探讨。
通过细胞增殖分析,MWF组ADMSCs的增殖速率显著下降。研究者推测,这可能与细胞衰老(senescence)有关。qPCR结果显示,MWF组细胞中衰老标志基因p16的表达显著升高;β-半乳糖苷酶染色进一步证实其衰老活性增强。
在超微结构层面,透射电镜观察到MWF组细胞线粒体内膜结构严重破坏,呈现肿胀、嵴断裂等典型线粒体功能障碍形态。为验证功能改变,研究者检测了氧化磷酸化(OXPHOS)复合物的蛋白表达水平,结果显示复合物Ⅲ、Ⅳ、Ⅴ在MWF组均明显下降,提示能量代谢受损。
García博士解释说:“这些细胞表现出一种典型的‘衰老-功能紊乱’表型:增殖能力下降、线粒体受损,但倾向于向成骨细胞分化,这可能与肾脏和血管组织中的钙化病理密切相关。”
四、研究结论:肾周脂肪——CKD钙化微环境的“活跃参与者”
综合结果表明,MWF CKD模型中来源于肾周脂肪的ADMSCs呈现出:
衰老表型:p16上调、增殖能力下降;
线粒体损伤:形态结构破坏,能量代谢障碍;
成骨潜能增强:在诱导分化条件下,钙盐沉积明显增多。
这些特征共同描绘出一种具有促钙化潜能的衰老干细胞亚型,暗示其可能在CKD相关血管钙化及肾间质病变中扮演重要角色。
正如García博士所言:“我们希望通过这项研究更深入理解CKD的病理过程——不仅限于肾脏内部肾脏血管本身,而是扩展到其周围组织的交互影响。”
五、临床启示与未来方向
García博士透露,未来团队将进一步探讨ADMSCs在不同分化方向(如向脂肪细胞分化)中的程序调控差异,并计划进行共培养实验:“我们将把来自MWF CKD大鼠的ADMSCs与健康肾细胞共培养,反之亦然,观察其相互作用。这样或许能更好地揭示肾周脂肪与肾脏损伤之间的双向交流机制。”
总结
这项来自西班牙马德里康普顿斯大学的研究,将目光从肾小球与肾小管扩展到“肾-周边组织生态系统”的层面,揭示了肾周脂肪来源间充质干细胞在慢性肾病钙化微环境中的潜在作用。其发现不仅为理解CKD血管钙化的病理基础提供了新证据,也提示肾周脂肪可能是未来干预慢性肾病进展的全新靶点。
- 推荐文章
