- 首页 > 正文
ASN热点聚焦 | 心肾轴研究新进展:高血压与心血管疾病——新机制、新治疗靶点
发表时间:2026-01-31 10:44:36
在2025年美国肾脏病学会(ASN Kidney Week 2025)上,“高血压与心肾疾病:新机制与新靶点”口头报告专场集中展示了心肾轴研究的最新进展。从肾神经去交感术(RDN)在慢性肾病(CKD)患者中的持续降压效果,到双重SGLT1/2抑制剂改善盐敏感性高血压,再到动态心脏磁共振揭示CKD患者的运动心功能损伤;从Npr1信号通路与性别差异的高血压表型,到外泌体介导的心肌损伤,这一系列研究揭示了心肾代谢疾病的复杂机制和新的干预路径。本文与读者分享本场报告的五项代表性研究。
一、DN术在CKD患者中的一年随访——持续降压效果可期?
【FR-OR039】Sustained Blood Pressure Reduction Following Ultrasound Renal Denervation in Patients with CKD: 12-Month Follow-Up Data from the RDN-CKD Study
肾交感神经去除术(renal denervation,RDN)被认为是治疗交感神经系统过度激活相关高血压的一种潜在策略。RDN-CKD随机、双盲、假手术对照试验结果显示,超声RDN(uRDN)后6个月3期CKD的高血压患者的舒张压降低。此次,德国埃尔朗根大学医学院的团队Dennis Kannenkeril等评估了uRDN后12个月的疗效与安全性。
15例来自埃尔兰根/纽伦堡中心的CKD 3期且高血压未控制的患者接受uRDN,12个月后评估其诊室和24小时动态血压和肾功能(表1)。结果显示,24小时动态收缩压和舒张压分别下降8.7±12.7 mmHg和6.5±9.3 mmHg;诊室血压下降更明显,平均收缩压下降11.9±16.4 mmHg,舒张压下降7.3±7.9 mmHg,且降压效果在未调整降压药物剂量的情况下维持12个月。与基线相比,肾功能在随访期间保持稳定,未见与uRDN相关的不良事件。
表1. 基线和uRDN 12个月后的随访结果
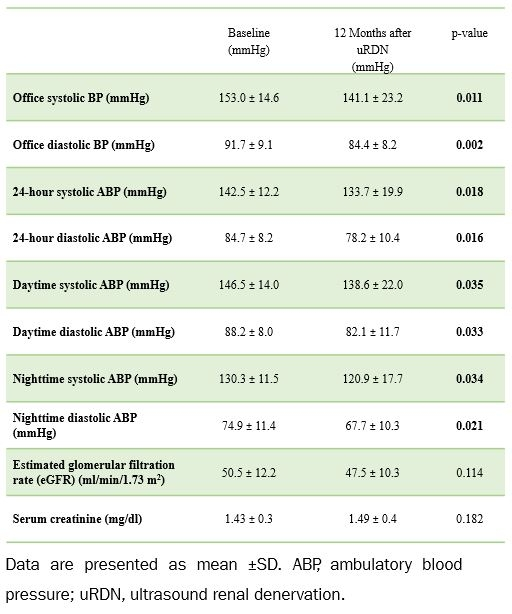
对于CKD 3期且高血压未控制的患者中,RDN不仅能持续降压且安全性良好,提示其或可成为中度CKD患者控制其高血压的一种有力辅助方法。随着RDN技术在中国的临床试验逐步展开,该研究为其在CKD人群中的应用提供了国际数据支撑。
二、双重SGLT1/2抑制剂在盐敏感性高血压中的作用
【FR-OR045】Dual SGLT1/2 Inhibition Attenuates Salt-Sensitive Hypertension and Kidney Injury More Effectively than SGLT2 Inhibition
SGLT2抑制剂因其显著的心肾保护作用而成为治疗糖尿病与慢性肾病的基石药物之一。近期,FDA批准了SGLT1/2双靶点抑制剂sotagliflozin(索格列净)用于治疗HFpEF和HFrEF。那么,其在盐敏感性(SS)高血压中的作用如何呢?来自南佛罗里达大学的Olha Kravtsova等团队,通过Dahl盐敏感大鼠模型,对比了SGLT2单靶点抑制剂达格列净(dapagliflozin)与双靶点抑制剂索格列净的效果。
对8周龄的Dahl SS大鼠进行达格列净(2 mg/kg/d)或索格列净(30 mg/kg/d)治疗3周,同时维持高盐饮食(4%NaCl)。Kravtsova等之前的研究发现,达格列净可阻止雄性和雌性Dahl SS大鼠高血压的发展,而不改变钠通道表达或肾素-血管紧张素-醛固酮系统。当治疗性给予时(高血压发展后),达格列净仍可降低血压。进一步研究发现,在高盐饮食条件下,索格列净较达格列净对3周后降低平均动脉压的影响更大(雄性大鼠:126±2 mmHg vs. 157±5 mmHg;雄性大鼠:126±3 mmHg vs. 167±10 mmHg),且不影响心率。索格列净组的体重减轻,尿钠、尿氯排泄量显著增加(分别为1.45倍和1.49倍),葡萄糖排泄分数更高(48% vs. 23%),提示其通过增强钠-糖协同排泄与代谢重编程实现更强的降压和肾保护效应。两组治疗均不影响肾小球滤过率。达格列净处理组的大鼠肾组织中,脂质代谢和炎症相关通路呈富集状态。有趣的是,预测皮质中的脂肪酸代谢会下调,而髓质中的脂肪酸代谢会上调,这一差异与脂质介质谱的改变一致。
结论及启示
该研究揭示了SGLT1/2双重抑制能更有效地降低盐敏感性高血压和减轻肾损伤,提示两种药物存在独特且可能具有累加效应的作用机制。鉴于中国人群高盐饮食普遍且盐敏感性高血压发病率高,这一结果为未来在高盐负荷人群中探索SGLT1/2双靶点药物提供了方向。
三、CRUISE-CKD研究:运动心脏MRI揭示CKD患者心功能动态损伤
【FR-OR042】Exercise Cardiac MRI and Cardiopulmonary Testing Reveal Distinct Exercise Phenotypes and Dynamic Cardiac Impairment in CKD: CRUISE-CKD Study
运动耐量下降与气促是CKD常见的临床症状,但其病理机制长期被低估。来自克利夫兰大学医院系统的Mirela Dobre团队采用无对比剂运动心脏磁共振(ECMR)结合心肺功能测试的创新方案,使用磁共振兼容卧式自行车,对CKD 3~4期患者运动状态下的心功能变化进行了动态评估。共纳入14例患者,估算肾小球滤过率[eGFR]均值为32.6~6.7 ml/(min·1.73m²),且均无心力衰竭病史。
研究显示,运动时左心室射血分数上升6.9%,每搏输出量增加12.7 ml;心排血量显著增加(+3.1 L/min),但双心室反应存在明显个体差异。平均最大摄氧量提升6.64 ml/kg/min(峰值均值为9.21 ml/kg/min),平均VE/VCO2斜率为8.2,提示通气效率受损。静息状态下心肌T1值升高,提示存在亚临床纤维化。运动时T1值升高和右心室(RV)储备功能减弱较为常见,且与较低的最大摄氧量相关。2例患者表现出右心反应过度,并有早期运动诱导性肺动脉高压的迹象。约三分之一患者表现出收缩储备受限或肺血流动力学异常。最终ECMR-CPT揭示了三种独特的表型:(1)射血分数保留但舒张储备受损型;(2)右心室-肺血管偶联障碍型;(3)骨骼肌主导的运动受限但心脏反应保留。
结论及启示
除肾小球滤过率(GFR)降低外,其他机制也参与了慢性肾脏病患者的运动不耐受。本研究表明,动态影像学可揭示静息状态难以察觉的心功能障碍。未来,基于表型分层的个体化干预(如运动康复、容量优化、右心功能改善)或成为改善CKD预后管理的重要方向。
四、Npr1基因缺失与盐敏感性高血压
【FR-OR044】Deletions of Npr1 in Nephron Tubule Cells Lead to Salt-Sensitive Hypertension and Kidney Dysfunction in Both Male and Female Mutant Mice
心房利钠肽(ANP)和脑利钠肽(BNP)与鸟苷酸环化酶A/利钠肽受体A(GC-A/NPRA)结合后,会生成第二信使环磷酸鸟苷(cGMP),进而调节血压(BP)、血管内容量和电解质稳态。肾小管(NTs)损伤常导致肾单位功能异常,引发肾功能丧失和血压升高。
Kandasamy Neelamegam等来自杜兰大学的研究团队关注NPRA信号通路在肾小管调控中的作用。他们通过特异性敲除肾单位上皮细胞的Npr1基因,建立了Npr1缺失小鼠模型,以探讨其对血压与肾功能的影响。
研究发现,无论雄鼠或雌鼠,Npr1缺失均导致平均动脉压、心率显著升高(P<0.01;P<0.001),肾小管Npr1基因敲除小鼠的收缩压显著高于野生型小鼠(雄性小鼠:132±5 mmHg,雌性小鼠125±4 mmHg),且GFR显著下降(雄性小鼠降低51%,雌性小鼠降低42%)(P<0.05;P<0.01),血肌酐升高、尿蛋白水平增加,而血浆总蛋白和白蛋白水平显著降低。这些变化在雄性受损更为明显。组织学分析显示,肾小管间质纤维化及间质炎症浸润在雄鼠中尤为显著。
结论及启示
该研究提示NPRA/cGMP通路在钠稳态和血压调控中的关键作用,肾单位中Npr1基因缺失会以性别特异性方式引发动脉高血压和肾脏功能血流动力学异常,并揭示了性别差异性病理机制。NPRA在中国的基础实验室已有部分研究,对于中国基础研究者而言,这一模型为阐明“盐敏感性高血压的分子遗传基础”提供了有价值的实验框架。
五、外泌体介导的心肌损伤与肾病性心衰
【FR-OR038】Exosomes as Mediators of Cardiomyocyte Injury and Heart Failure in Experimental Glomerular Disease
纽约西奈山医学院的Justina Ray等提出了一个重要假设:肾源性外泌体可能是肾病性心衰的“分子信使”。他们构建了足细胞特异性LATS1/2双敲除小鼠(PodLats-KO),该模型在5周龄时即出现白蛋白尿与局灶节段性肾小球硬化(FSGS),并在22周龄发展为双心室功能不全和早期心衰死亡。
尽管肾功能尚可、血压正常,PodLats-KO小鼠仍过早死亡(中位生存期:24.8周)。22周龄时,心脏磁共振显示双心室收缩功能障碍和心脏肥大。野生型(WT)小鼠的射血分数下降,显著低于对照:左心室EF 43.1%(vs. 对照组60.2%,P<0.0001),右心室EF 43.3%(vs. 对照组71.6%,P<0.0001)。无线电遥测监测显示,小鼠死亡前出现T波抬高,提示存在心肌缺血。在细胞水平上,PodLats-KO小鼠的心肌细胞收缩力降低、钙处理功能受损、存在氧化应激且发生凋亡。左心室组织的RNA测序显示广泛的转录失调,包括对心脏收缩至关重要的通路下调。
进一步分析显示,从病变肾脏分离的外泌体对H9C2心肌母细胞具有心脏毒性(P<0.05),会导致原代大鼠心肌细胞收缩功能受损(P<0.001),且向健康对照小鼠左心室心肌内注射后会诱导凋亡(P<0.01)。
结论及启示
PodLats-KO小鼠会发生伴白蛋白尿的局灶节段性肾小球硬化、双心室心力衰竭及早期心脏死亡,为探究肾小球疾病中肾脏与心脏之间的分子信号传导提供了创新模型。研究数据表明,肾脏来源的外泌体可能参与心肌细胞损伤和心肌损害的发生。未来,阻断外泌体生成或拦截其心肌摄取,可能成为心肾联合治疗的新策略。
结语:从机制到干预,心肾代谢疾病研究的新格局
本场ASN专题汇集了基础与临床研究的多维成果:RDN为CKD合并高血压患者带来非药物降压新选择;SGLT1/2双重抑制拓宽了钠-糖代谢干预思路;运动心脏MRI揭示CKD心功能动态异常;Npr1基因研究深化了盐敏感性机制认识;外泌体研究则搭建起“肾-心通讯”的分子桥梁。
这些成果共同勾勒出“从肾小管到心肌、从神经调控到代谢重塑”的心肾疾病治疗新版图。在心肾代谢综合征(CKM)逐渐成为临床焦点的当下,这些发现不仅拓展了病理生理理解,更为未来精准干预提供了坚实科学依据。
- 推荐文章
