- 首页 > 正文
ASN中国之声 | 刘友华团队研究:肾脏疾病新突破——损伤的“足细胞”如何用“钥匙”打开肾小球硬化的大门?
发表时间:2026-01-31 10:56:37
在2025年美国肾脏病学会年会(ASN 2025)上,南方医科大学南方医院刘友华教授团队口头报告了一项研究成果(摘要号:FR-OR062),揭示了肾小球疾病的新机制:足细胞损伤释放的FBN1可作为表皮生长因子受体(EGFR)的新型配体,激活EGFR/PI3K/AKT通路,从而驱动系膜细胞活化与肾小球硬化。这一发现不仅阐明了足细胞与系膜细胞间的信号联系,更拓展了细胞外基质蛋白在肾脏病理中的功能边界,为阻断肾小球硬化提供了潜在新靶点。
在肾小球疾病发生过程中,蛋白尿和肾小球硬化是两大核心病理特征。足细胞损伤被认为是肾小球疾病中滤过屏障完整性破坏、通透性增加和蛋白尿产生的早期事件,而系膜细胞活化则导致细胞外基质(ECM)过度沉积,最终形成肾小球硬化。然而,这两者之间究竟是如何联系的,一直是个未解之谜。
Fibrillin-1(FBN1)是一种分子量大、富含半胱氨酸的细胞外糖蛋白,包含多个表皮生长因子(EGF)样结构域和一个潜在转化生长因子(TGF)- β结合蛋白(LTBP)结构域。过去,FBN1主要被认为是结构性ECM蛋白,与马凡综合征等结缔组织疾病相关。但最新研究发现,它可能扮演着更为活跃的角色:不仅是细胞外基质的“建筑师”,更是细胞间通讯的“信号使者”。它以一种新型的细胞间通讯方式,即通过形成特殊的细胞外基质微环境来发挥作用。有研究发现,肾小管细胞分泌的FBN1能够通过激活TGF-β1/Smad3信号通路促进内皮细胞凋亡并导致管周血管稀疏化。然而,FBN1在肾小球疾病中的作用和机制尚不完全清楚。
刘友华团队最近研究首次系统揭示了FBN1在肾小球疾病中的作用。他们在多种蛋白尿性肾小球疾病(包括糖尿病肾病、局灶性节段性肾小球硬化、狼疮性肾炎等)的肾活检组织中发现:FBN1在受损的足细胞中特异性表达增高,提示它可能是足细胞在应激状态下释放的关键信号分子(图1)。
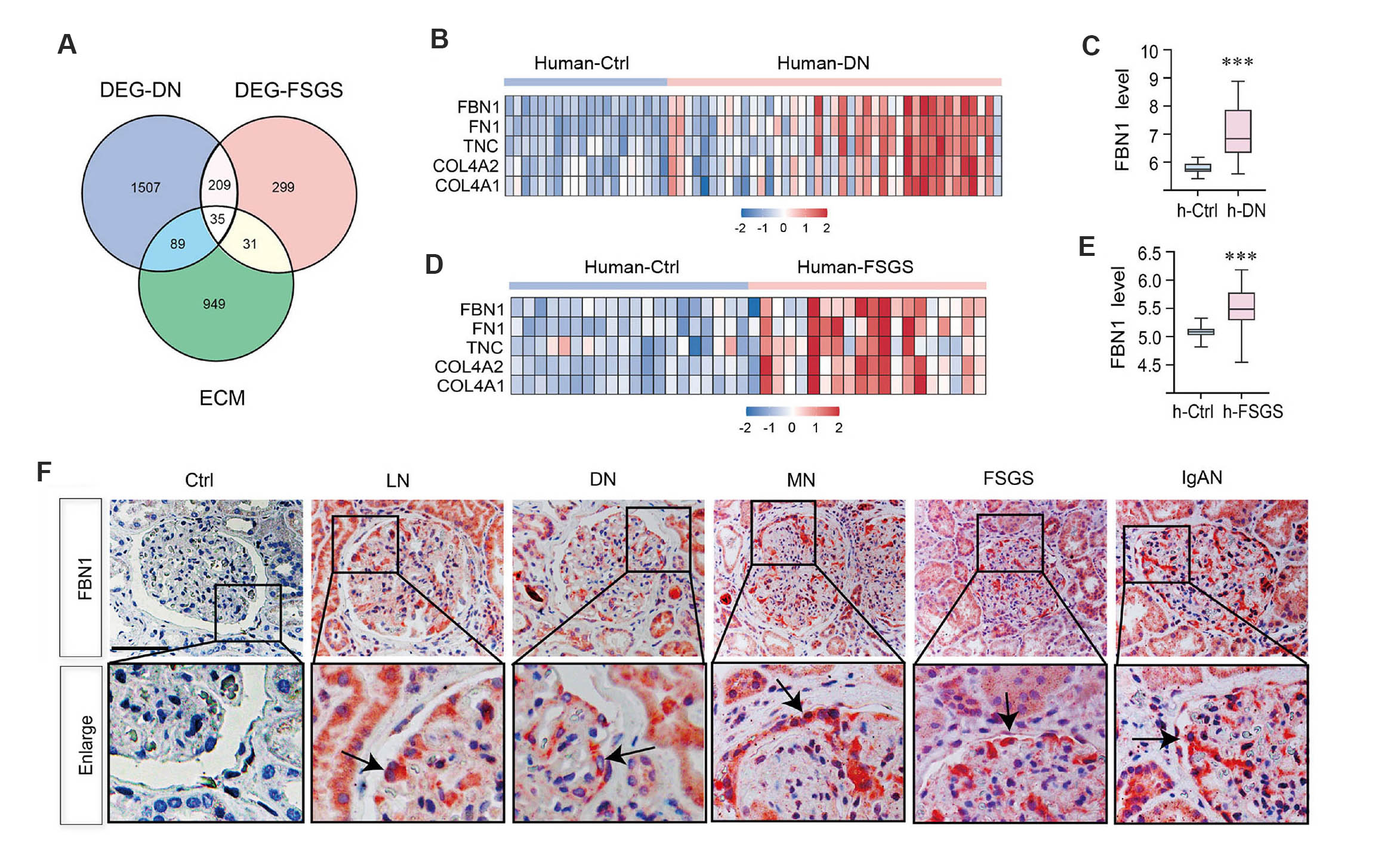
图1. FBN1在多种蛋白尿型慢性肾脏病患者的足细胞中表达上调
此外,通过构建肾小球微器官培养,研究者们发现FBN1能特异性靶向系膜细胞,促进其活化和增殖(图2)。
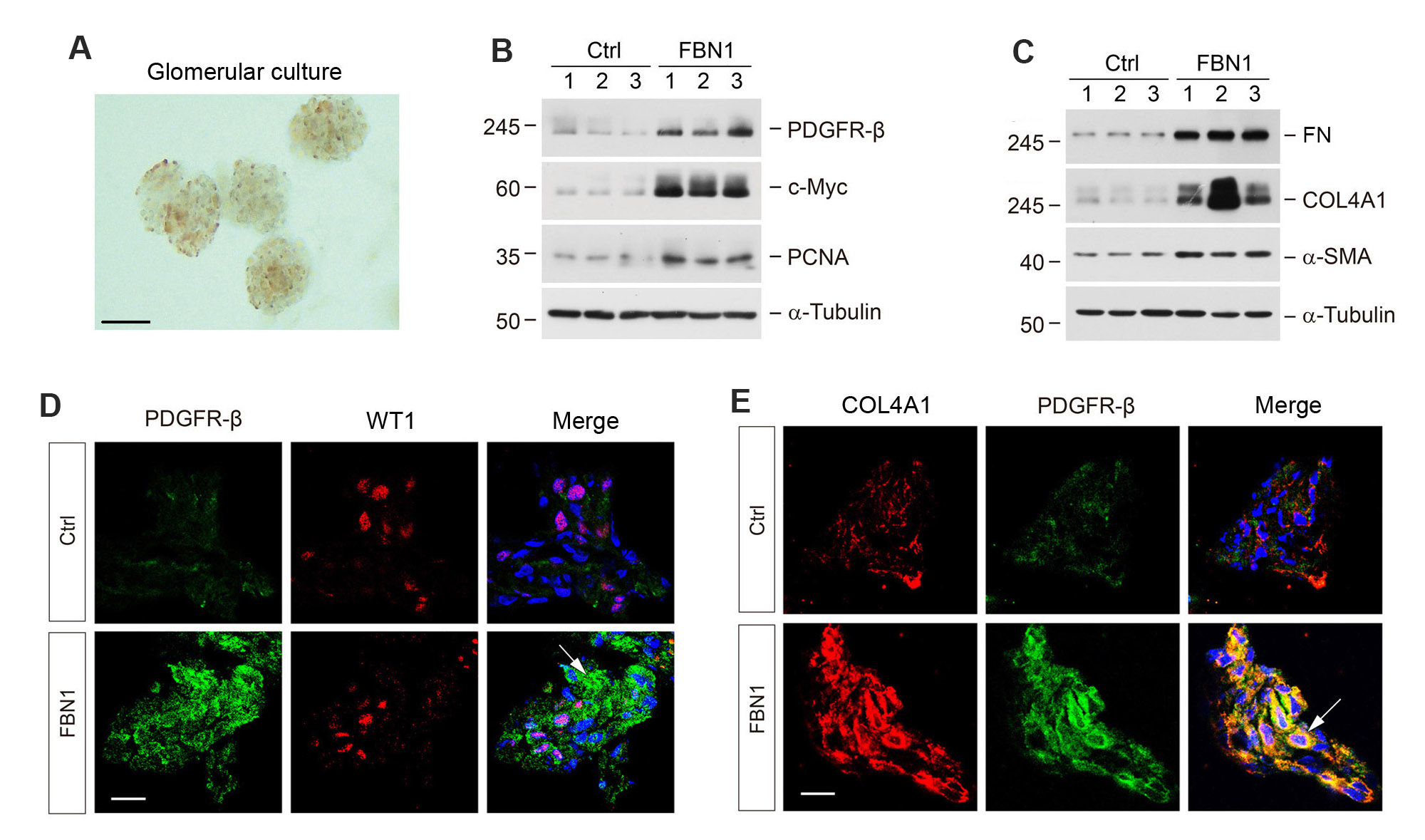
图2. FBN1在体外的肾小球微器官培养环境中诱导系膜细胞的活化和增殖
为了证明足细胞来源的FBN1对系膜细胞的激活作用,研究者们构建了足细胞特异性的FBN1基因敲除小鼠。免疫蛋白印迹、免疫组化染色和病理染色结果提示,足细胞特异性敲除FBN1可以有效减轻ADR损伤后的系膜细胞活化和肾小球硬化(图3)。
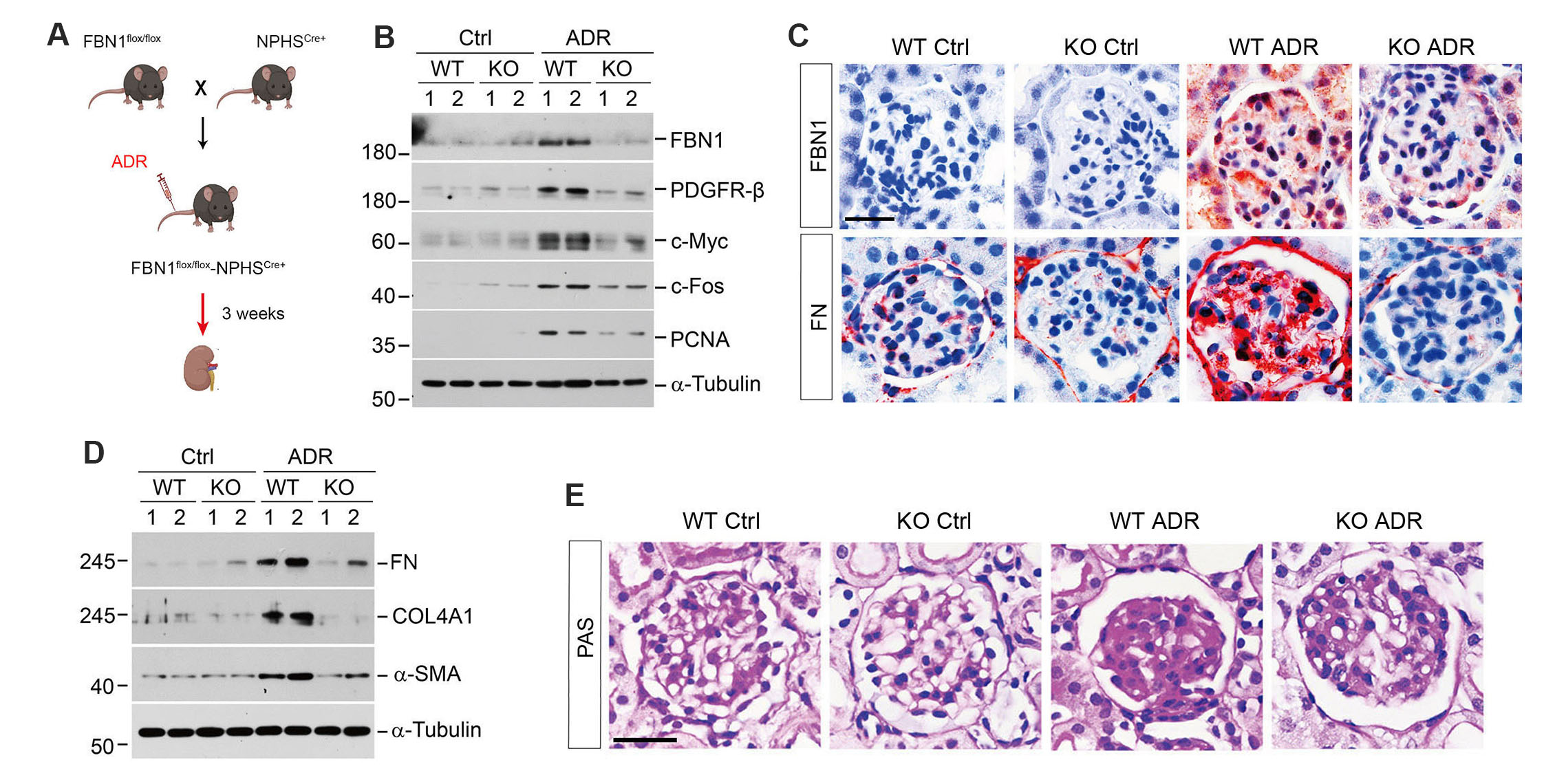
图3. 足细胞特异性敲除 FBN1 基因可减轻肾小球损伤后的系膜细胞活化和肾小球硬化
为了探究FBN1触发系膜细胞活化和增殖的潜在机制,该研究通过RNA测序、分子对接模拟和蛋白质相互作用分析发现,FBN1可以直接结合系膜细胞中的表皮生长因子受体(EGFR),从而导致EGFR、磷酸肌醇3-激酶(PI3K)和AKT激酶的磷酸化和激活。与EGFR经典配体EGF相比,FBN1快速且持续性激活EGFR、PI3K和AKT信号通路,但不激活细胞外信号调节激酶-1和-2(ERK1/2)(图4和图5)。这些结果提示,FBN1是一种新型的EGFR的配体,通过EGFR/PI3K/AKT信号通路快速且持续激活系膜细胞。
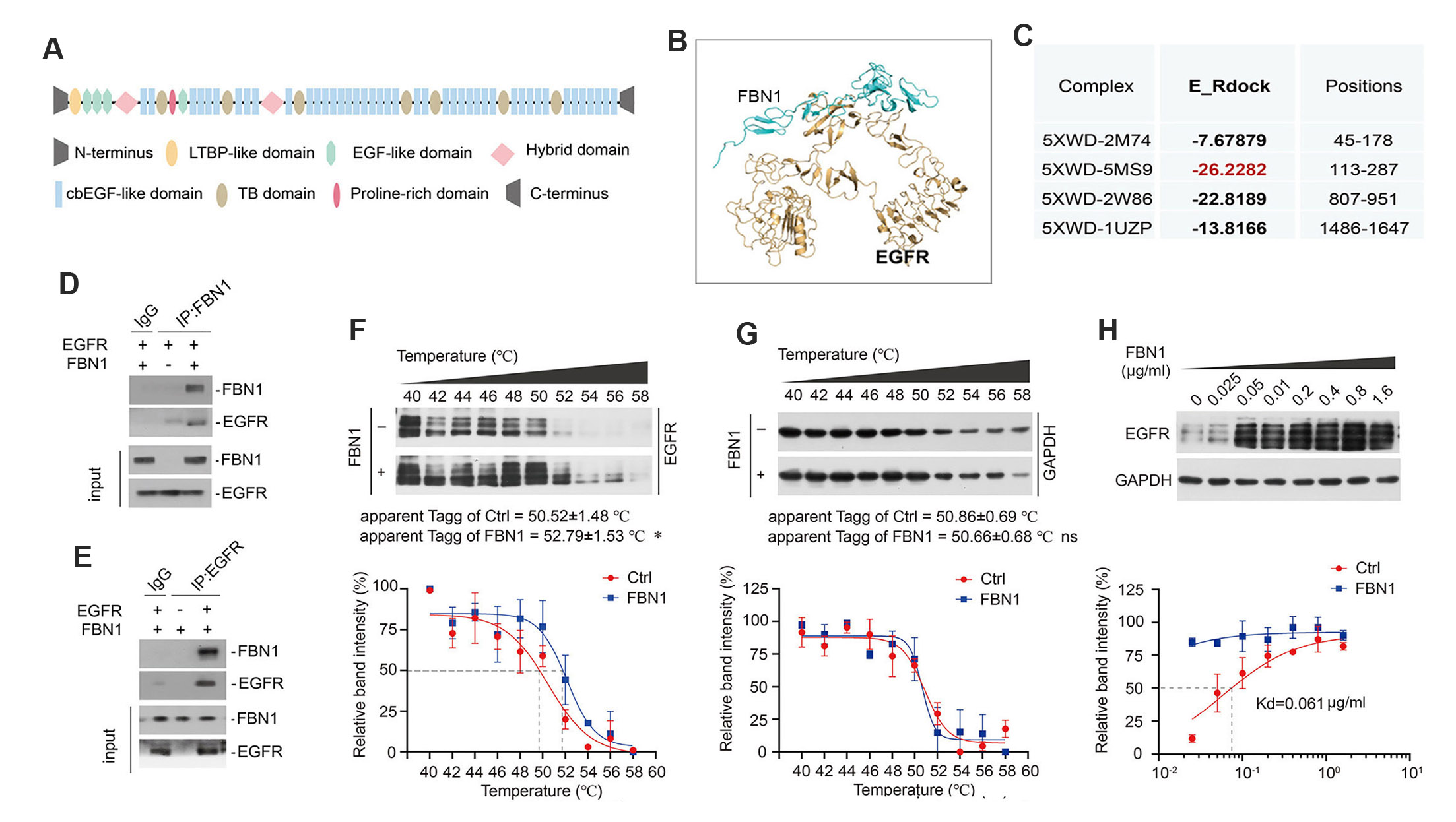
图4. FBN1是一种EGFR的新型配体
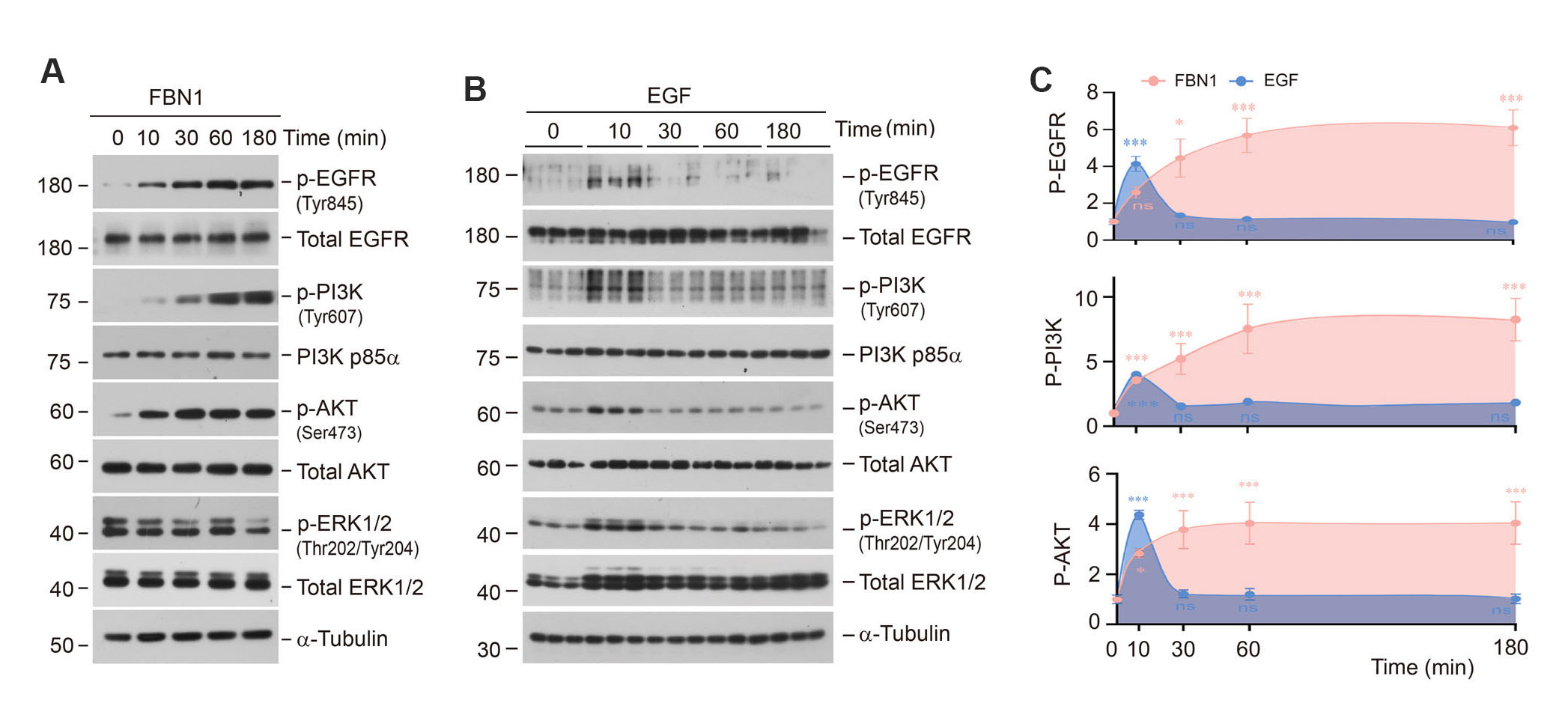
图5. 与EGF不同,FBN1可以快速且持续激活EGFR/PI3K/AKT信号通路
此外,研究者们还在过表达FBN1的阿霉素小鼠模型中给予了EGFR的抑制剂厄洛替尼。结果发现使用厄洛替尼有效抑制FBN1所诱导的系膜细胞活化、肾小球硬化和EGFR信号通路的磷酸化水平(图6)。
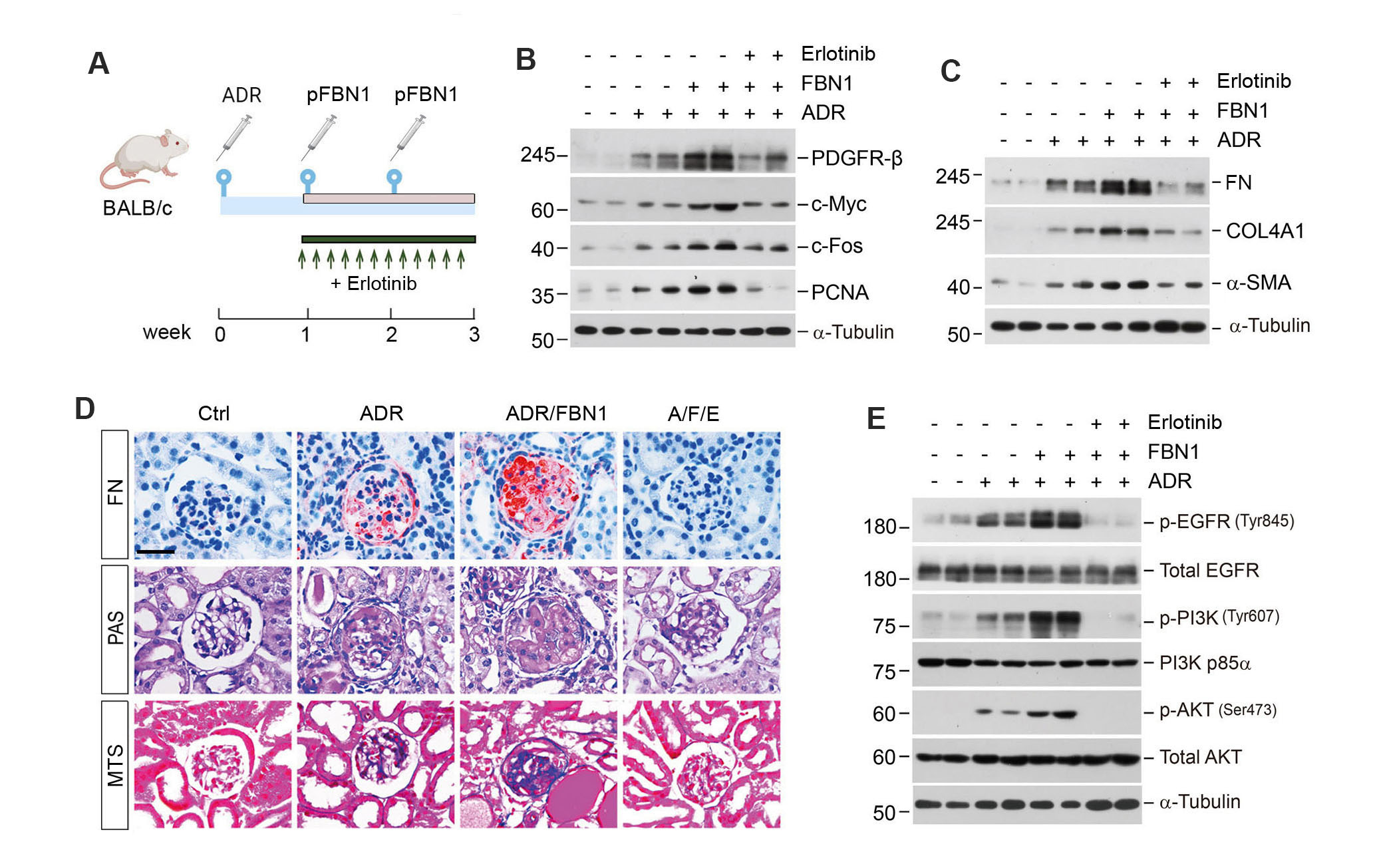
图6. 厄洛替尼可以减轻FBN1所诱导的系膜细胞活化和肾小球硬化
综上,本研究的结果证明,足细胞损伤可以上调表达大量FBN1,并释放到细胞外,通过特异性识别并结合系膜细胞膜表面表达的EGFR,从而激活下游信号通路,促进系膜细胞活化和增殖,导致ECM过度积累和肾小球硬化。
本研究的通讯作者刘友华教授解释道:这个研究不仅解开了肾小球疾病中足细胞-系膜细胞通讯的长期谜题,更重新定义了细胞外基质蛋白的功能边界——它们不仅是静态的“支撑结构”,更是动态的“信号枢纽”。该研究的发现首次揭示了FBN1是EGFR先前未被识别的新型配体,通过EGFR/PI3K/AKT信号级联驱动系膜细胞活化。这些研究为阐明足细胞损伤与系膜活化之间的联系提供了机制性的见解,并为未来开发治疗肾小球疾病的策略铺平了新的路径。
专家简介

南方医科大学南方医院肾内科教授
国家特聘专家、国家基金委创新研究群体负责人
多器官损伤防治全国重点实验室常务副主任
广东省肾脏病研究所副所长
中国病理生理学会肾脏病专业委员会副主任委员
曾任美国匹兹堡大学终身教授、UPMC冠名终身讲席教授发表SCI论文240余篇、论文被引用32,400余次,H-指数=100。


- 推荐文章
