- 首页 > 正文
ASN热点聚焦 | 糖尿病肾病精准治疗:从SGLT2i应答异质性到非奈利酮真实世界数据与三联治疗潜力
发表时间:2026-01-31 11:02:55
在2025年美国肾脏病学会(ASN 2025)“糖尿病肾病精准医学”专场汇报了多项重要研究结果。本文精选三项研究与读者分享,这三项研究从不同角度呈现了DKD治疗领域的最新进展:从识别SGLT2i的“无应答者”,到非奈利酮真实世界数据,再到三联治疗的临床前景,为糖尿病肾病的个体化诊疗提供了关键循证依据。
研究一:识别SGLT2抑制剂无应答者——CREDENCE试验生物标志物分析
【TH-OR075】Identifying Nonresponders to SGLT2 Inhibitors in the CREDENCE Trial: Biomarker-Guided Approach for Targeting Alternative Therapies
背景:SGLT2抑制剂可降低2型糖尿病(T2D)合并慢性肾脏病(CKD)患者的主要肾脏事件(MKE),但个体应答存在差异。美国波士顿Joslin糖尿病和内分泌研究中心的Sok Cin Tye等开展了一项研究,旨在通过生物标志物识别卡格列净无应答者,为早期启用替代治疗提供支持。
方法:纳入CREDENCE试验中1356例T2D合并3~4期CKD患者,检测基线时Joslin肾脏面板的21种血浆蛋白水平,主要结局为肾衰竭和/或eGFR下降≥50%。采用Kaplan-Meier法估算3.5年累积发病率,Weibull参数生存模型预测10年风险。
结果:3.5年时,安慰剂组和卡格列净组MKE累积发病率分别为35.6%和18.5%,风险降低17.2%。
肿瘤坏死因子受体1(TNFR1)与MEP1B(肾素A亚基β)联合检测可最优分层患者,其中44%的患者(603例)被归为无应答者,56%为应答者(753例)。无应答者从卡格列净治疗中获益甚微(安慰剂组:28.7% vs. 卡格列净组:25.4%;风险降低3.3%,95%CI:-16.0~9.4),而应答者则获得显著改善(安慰剂组:41.1% vs. 卡格列净组:13.3%;风险降低27.8%,95%CI:-37.5~-17.8)。10年预测结果进一步证实该分层效果(图1)。
结论:基线TNFR1和MEP1B可有效识别卡格列净无应答的T2D合并CKD患者,为个体化替代治疗提供支撑。
临床启示
这项研究为DKD的精准治疗提供了强有力的工具。未来,通过检测TNFR1和MEP1B,我们或许能在治疗前就筛选出对SGLT2i不敏感的患者,从而避免无效治疗,推动糖尿病肾病治疗从“一刀切”向“个体化”转变。
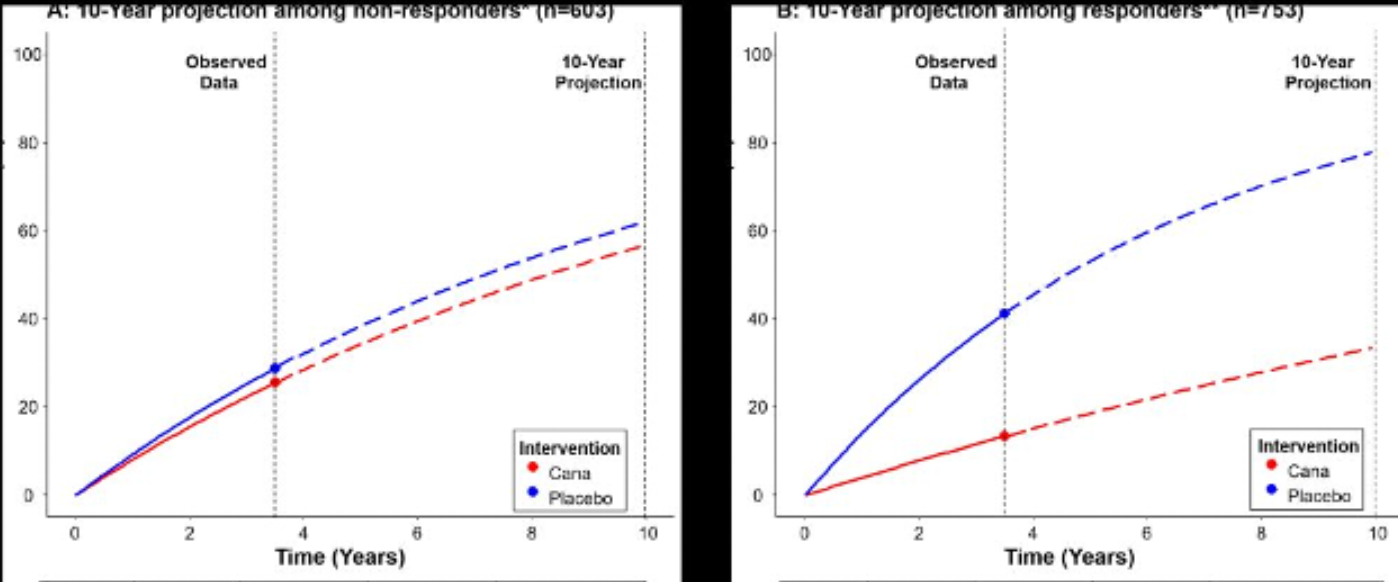
图1. 10年预测结果
研究二:非甾体盐皮质激素受体拮抗剂非奈利酮真实世界应用:FINE-REAL的中期分析
【TH-OR080】Dosing, Treatment Patterns, Urine Albumin-to-Creatinine Ratio (UACR) Changes, and Safety with Finerenone Treatment in Routine Care: FINE-REAL Interim Analysis
背景:FINE-REAL研究(NCT05348733)旨在评估非奈利酮在T2D合并CKD患者中的真实世界应用情况,墨西哥Ricardo Correa-Rotter等的这项中期分析聚焦给药剂量、治疗模式、尿白蛋白/肌酐比值(UACR)变化及安全性。
方法:全球前瞻性单臂非干预性研究,纳入3505例患者,中位随访334天。
结果:所纳入的患者中,男性2309例(占66%),平均年龄为67岁(标准差11岁),中位随访时间334天(四分位数范围:224~367天)。基线时,3388例患者的平均估算肾小球滤过率(eGFR)为53 ml/(min·1.73m²)。
合并用药方面,2837例(81%)患者使用肾素-血管紧张素-醛固酮系统抑制剂(RAASi),2020例(58%)使用钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i),955例(27%)使用胰高血糖素样肽-1受体激动剂(GLP-1RA)。
非奈利酮初始给药剂量方面,2917例(83%)患者起始剂量为10 mg,588例(17%)为20 mg。UACR相关数据详见表1,患者基线中位UACR为322 mg/g(处于较低水平)。
安全性方面,1321例(38%)患者出现治疗期间不良事件,376例(11%)出现严重不良事件;285例(8%)患者报告治疗相关高钾血症,其中23例(0.7%)为严重高钾血症,仅7例(0.2%)因高钾血症住院,4例(0.1%)因高钾血症永久停药,无患者因高钾血症需透析或导致死亡。
结论:与FIDELIO-DKD等其他主要研究相比,FINE-REAL中患者肾损伤更轻,SGLT2i或GLP-1RA的合并用药率高于常规真实世界临床实践。在更密集背景治疗的情况下,非奈利酮治疗仍使从基线至治疗4个月期间的UACR显著降低,12个月时无明显进一步变化。安全性与已知特征一致。
临床启示
真实世界中,在合并多种标准疗法的“高强度”治疗背景下,仍展现良好的尿蛋白降低效果和安全性,高钾血症风险可控,为合并多种基础用药的糖尿病肾病患者提供了安全选择。
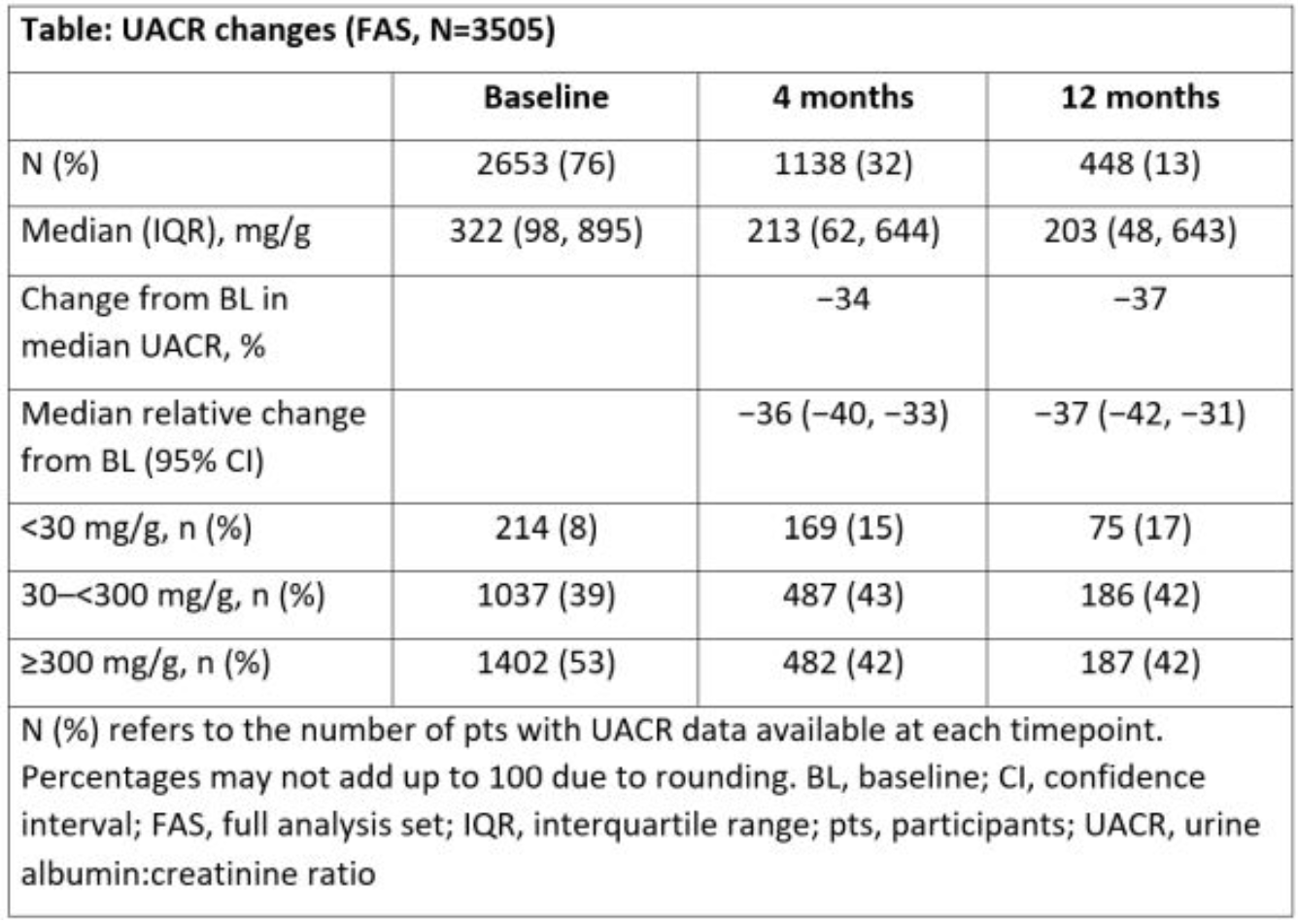
表1. UACR的变化(FAS,n=3505)
研究三:糖尿病肾病三联疗法的肾保护潜力
【TH-OR081】Potential of Triple Therapy in Diabetic Kidney Disease
背景:CKD是T2D的严重并发症,RASi、SGLT2i和GLP-1RA均具有肾保护作用,但三者联合(三联疗法)的效果尚不明确。
方法:美国阿肯色医科大学LeanAlkhatib等开展了这项回顾性队列研究,纳入18 911例T2D合并CKD或白蛋白尿患者,按治疗方案分为单药治疗组(MT:RASi、SGLT2i或GLP-1RA单一用药;n=14 092例)、双药治疗组(DT:任意两种药物联合;n=2450)和三联疗法组(TT:三种药物联合≥6个月;n=2369)。主要结局为eGFR持续下降≥50%、终末期肾病(ESKD)或全因死亡的复合终点。次要结局包括eGFR下降斜率和尿白蛋白/肌酐比值(UACR)的变化。多变量模型对包括基线eGFR在内的混杂因素进行了调整。
结果:与MT相比,TT显著降低主要结局风险(HR 0.60,95%CI:0.38~0.95,P=0.029)(图2),但与DT相比无统计学差异(HR 0.80,P=0.240)。
TT组eGFR下降速度显著慢于DT和MT,分别为1.2 vs. 2.1 vs. 3.5 ml/(min·1.73m²)/年(均P<0.001)。针对基线eGFR<60 ml/(min·1.73m²)患者的亚组分析显示,结果一致且显著:三联疗法组年均eGFR下降1.5 ml/(min·1.73m²),双药治疗组为2.1 ml/(min·1.73m²)(P=0.012),单药治疗组为3.5 ml/(min·1.73m²)(P<0.001)(图3)。
无论基线UACR水平如何,TT组UACR降幅均更大(基线≥300 mg/g时降幅60% vs. 45% vs. 25%;基线<300 mg/g时降幅50% vs. 40% vs. 22%,均P<0.001)(图4)。
结论:与单药和双药治疗相比,三联疗法可显著减慢eGFR下降速度、增强尿蛋白降低效果,展现出潜在的肾保护价值。
临床启示
三联疗法为糖尿病肾病患者提供了更强效的肾保护策略,尤其适用于eGFR下降风险较高的患者,但需权衡治疗获益与成本,个体化制定联合方案。
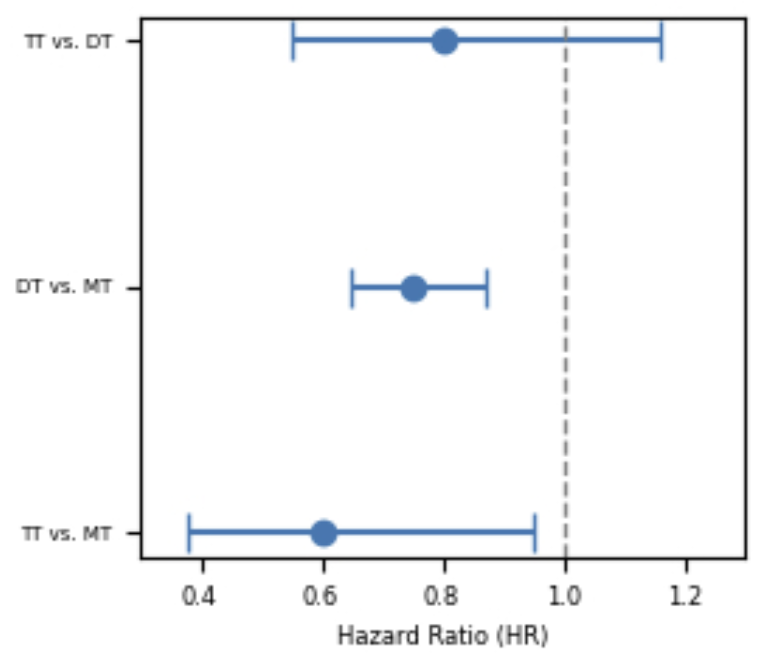
图2. 各治疗组主要结局的风险比(HR)比较
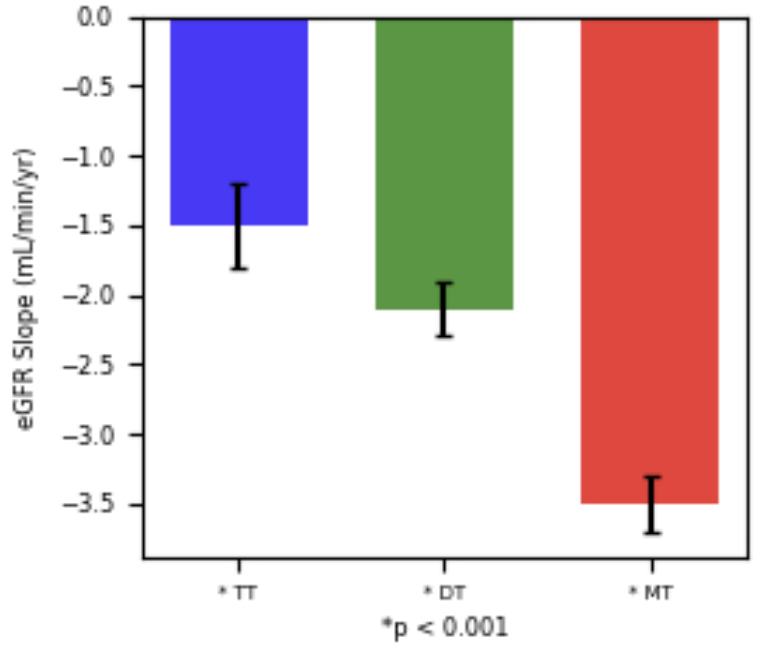
图3. 各治疗组的eGFR下降斜率
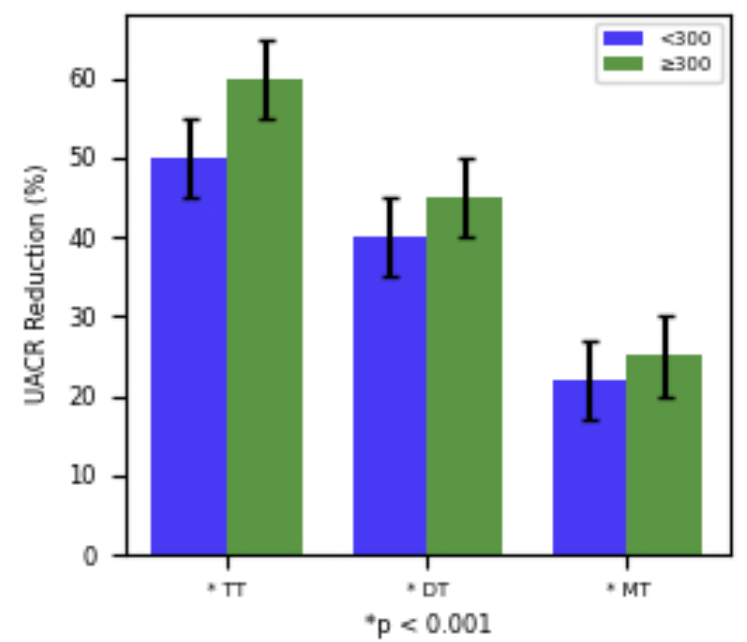
图4. 各治疗组按基线UACR水平(<300 vs. ≥300 mg/g)分层后的UACR降幅
总结
三项研究共同勾勒出糖尿病肾病精准治疗的关键方向:通过TNFR1与MEP1B识别SGLT2i无应答者,从而实现SGLT2抑制剂疗效预判;非奈利酮真实世界数据强化了其在多重联合背景下的安全性与持续降尿蛋白作用;三联治疗初步显示在eGFR保护与UACR改善方面最具潜力。这些发现为未来中国DKD临床路径的“个体化、分层化、组合化”治疗策略奠定了坚实基础。
- 推荐文章
