- 首页 > 正文
ASN 2025 | 研究者病例解读:罕见但致命的挑战——复发性血栓性微血管病的诊断与治疗抉择
发表时间:2026-01-31 11:21:28
血栓性微血管病(TMA)是一类以微血管内血栓形成、内皮损伤为特征的危重疾病,常累及肾脏,可导致急性肾损伤甚至多器官衰竭,其病因复杂、预后异质性大且复发风险不容忽视。近年来,随着补体抑制剂的应用,部分患者的预后显著改善,但复发性TMA的诊断与长期管理仍面临巨大挑战。在2025年美国肾脏病学会(ASN)年会上,美国布莱根妇女医院的Zoe A. Hirschi博士以壁报形式展示了一例COVID-19相关复发性TMA病例报告(摘要号:FR-PO0914),引发了学界对该病诊断复杂性与治疗决策的广泛讨论。《肾医线》记者在会议现场邀请该壁报研究第一作者Zoe A. Hirschi博士接受专访,深入解析了病例背后的临床挑战与研究方向。
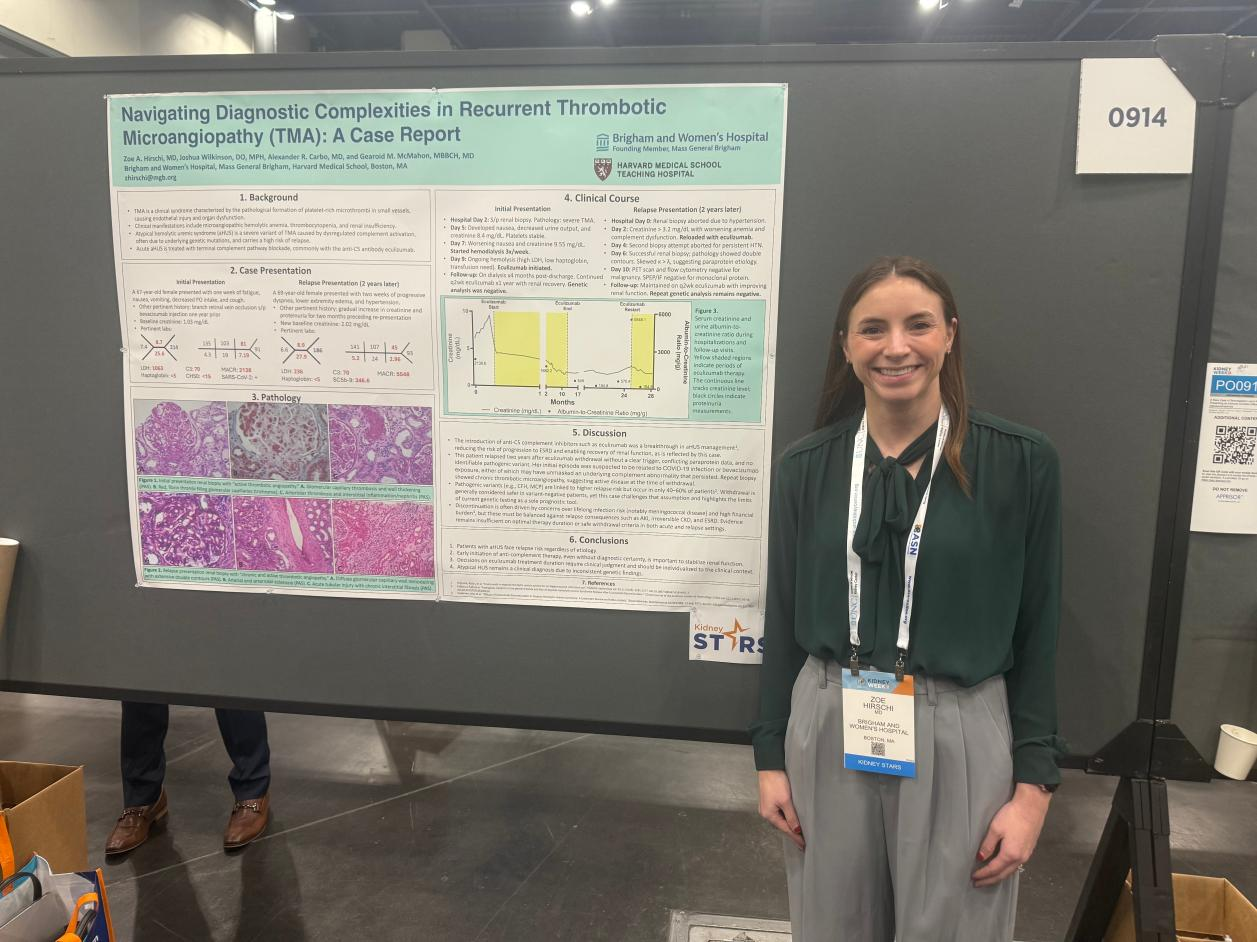
病例聚焦:一例复发性TMA的诊疗经过
该病例为一例69岁女性患者,首次发病时因感染新冠病毒感染(COVID-19)后出现典型TMA表现——溶血性贫血、血小板减少,同时合并急性肾衰竭,需接受透析治疗,肾活检明确活动性TMA病理改变。鉴于TMA与补体系统异常的密切关联,患者启动依库珠单抗抗补体治疗,疗程持续1年。治疗期间,患者基线血肌酐稳定在2.02 mg/dL,尿微量白蛋白/肌酐比值(UACR)为245.5 mg/g,病情得到有效控制。但初始基因检测未发现明确的致病性变异,缺乏支持长期治疗的遗传学依据,因此在治疗1年后停用依库珠单抗。
然而,停药2年后,患者因呼吸困难、水肿及高血压再次就诊,检查显示血肌酐升至3.01 mg/dl,UACR急剧升高至5548 mg/g,同时合并溶血性贫血,提示TMA复发。实验室检查发现补体C3持续降低、可溶性C5b-9升高,进一步支持补体介导的病理过程。
重复肾活检显示,肾脏组织广泛毛细血管壁双轮廓形成,与初次活检相似,免疫荧光检测还发现新增的轻链分布异常,但血清蛋白电泳、PET-CT及流式细胞术均排除了副蛋白相关疾病,因此仍考虑复发性补体介导的TMA。尽管再次基因检测仍未明确高危突变,临床团队仍重启了依库珠单抗治疗,患者出院时血肌酐、溶血指标趋于稳定,蛋白尿显著改善,目前计划长期维持治疗。
临床挑战:诊断与治疗的双重困境
Hirschi博士在访谈中指出,该病例集中体现了复发性TMA的核心诊疗难点。
从诊断层面看,TMA病因异质性极强,补体调节异常、药物诱导、感染等均可能成为诱因,而现有检查手段存在局限性——基因检测虽为重要参考,但部分患者可能缺乏可检测的致病突变,或当前基因检测panel未涵盖关键驱动基因,导致无法通过遗传学指标明确病因。本例患者两次基因检测均无明确阳性结果,却出现典型的复发表现,凸显了“临床表型与遗传学结果不匹配”的诊断困境。
治疗决策的不确定性则是另一大挑战。“目前,对于抗补体治疗的疗程、停药后的复发风险分层,以及如何整合基因检测结果指导治疗,均缺乏统一指南”。传统观点认为,无明确高危基因变异的患者可在病情缓解后停药,但本例患者停药后复发的经历提示,单纯依赖遗传学指标可能导致治疗不足。Hirschi博士强调:“治疗决策必须个体化,临床判断应优先于单一检测结果。对于初始病情严重(如需要透析)且对依库珠单抗反应良好的患者,延长治疗时长可能带来更多获益。”
专家启示:临床与科研的未来方向
谈及病例的科学意义与临床价值,Hirschi博士表示,该病例再次验证了“综合诊疗策略”的重要性——在TMA的诊断与治疗中,需整合患者临床症状、实验室检查、病理结果及治疗反应,而非过度依赖某一项检测指标。基因检测虽为重要工具,但仍处于不断发展阶段,现有技术无法覆盖所有致病机制,因此临床医生需保持警惕,关注不典型病例的诊治。
对于未来研究方向,Hirschi博士透露:“团队计划扩大病例系列,纳入更多对依库珠单抗有反应的TMA患者,开展更全面的基因测序分析”。这一长期研究有望明确补体介导性TMA的潜在遗传驱动因素,优化复发风险分层体系,为制定个体化治疗方案提供循证依据。同时,该研究也将为完善抗补体治疗的疗程指南提供关键数据,助力解决“何时停药、是否需要长期维持治疗”等临床核心问题。
结语
复发性TMA的诊疗困境,本质上反映了罕见病“病因复杂—检测局限—指南缺失”的共性挑战。该病例及专家解读提示,临床医生需以患者为中心,将精准检测与临床智慧相结合,实现个体化治疗;而通过扩大病例研究、深化机制探索,有望逐步破解诊疗难题,为TMA患者带来更精准的治疗策略与更好的预后。
- 推荐文章
