- 首页 > 正文
知其所以然!REMODEL研究重磅公布,司美格鲁肽肾脏获益机制揭秘
发表时间:2026-01-31 14:18:20
2025年11月7日,在美国肾脏病学会(ASN)年会美国肾脏周举办期间,REMODEL研究结果重磅公布,这是首项聚焦肠促胰素疗法治疗T2DM合并CKD的作用机制研究,揭示了司美格鲁肽注射液1.0 mg的肾脏保护机制[1]。探索循证获益背后的作用机制,有助于临床上更深入理解司美格鲁肽肾脏获益的独特优势,也为其成为T2DM合并CKD新的治疗支柱提供更多支持。
一、知其然:
司美格鲁肽确证肾脏获益,T2DM合并CKD治疗取得新突破2型糖尿病(T2DM)合并慢性肾脏病(CKD)疾病负担沉重,且治疗现状不理想。据估计,约40%的T2DM患者合并CKD[2]。糖尿病是终末期肾病(ESKD)的首要病因,约50%的ESKD是由T2DM相关CKD所致[3,4]。T2DM合并CKD显著增加肾脏和心血管不良结局及死亡风险,既往治疗手段有限,临床亟需新型疗法以进一步降低患者肾衰竭和心血管疾病风险。
近年来,GLP-1RA司美格鲁肽的肾脏保护证据不断积累,为T2DM合并CKD管理带来新希望。最初,司美格鲁肽的肾脏获益在T2DM人群心血管结局研究的次要终点或探索性分析中被发现,直至2024年里程碑性FLOW研究公布,其肾脏获益终得以确证。
FLOW研究是GLP-1RA类药物首个肾脏结局研究,结果证实,T2DM合并CKD患者在标准治疗基础上,应用司美格鲁肽1.0 mg可进一步带来肾脏获益,包括显著降低主要肾脏复合事件风险24%,降低尿白蛋白肌酐比值(UACR)水平达40%,并延缓肾功能下降;同时还可带来显著的心血管获益和生存获益。不同基线和临床特征的广泛患者均可一致获益[5]。
司美格鲁肽确证肾脏获益为T2DM合并CKD治疗带来重大新突破。然而,知其然,更要知其所以然,循证获益背后的机制是什么?研究者专门开展了探寻司美格鲁肽肾脏保护的作用机制研究。
二、 知其所以然:
REMODEL研究揭示,司美格鲁肽通过多种机制实现肾脏保护REMODEL研究方法:首项针对GLP-1RA肾脏作用机理的Ⅲ期临床研究
REMODEL研究是一项为期52周、随机、双盲、平行组Ⅲ期临床研究,共纳入8个国家106例T2DM合并CKD患者(其中肾活检亚组33例),按2:1随机分为两组,接受司美格鲁肽注射液1.0 mg或安慰剂治疗。研究使用多参数磁共振成像(MRI)、临床指标、生物标志物和肾脏活检,从多方位评估司美格鲁肽对氧化应激、炎症和血流动力学等参数的影响(图1)[1,6]。
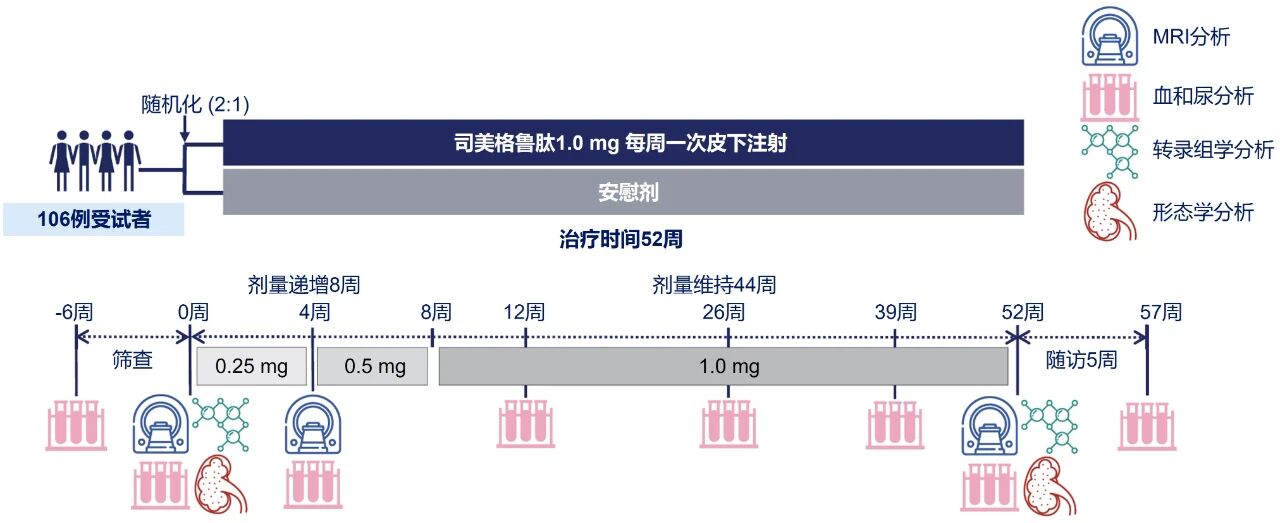
图1. REMODEL研究设计
REMODEL重要发现:司美格鲁肽主要通过降低肾脏脂肪、改善血流动力学和稳定肾脏纤维化等机制保护肾脏
基线时,患者平均年龄65.3岁,平均糖尿病病程14.7年,平均HbA1c水平7.1%,平均体重指数(BMI)30.8 kg/m2,估算肾小球滤过率(eGFR)51.1 ml/min/1.73m2,中位UACR 187.3 mg/g。该研究发现,治疗52周后,与安慰剂组相比,司美格鲁肽组患者以下指标发生重要改变:
01肾脏脂肪显著减少
司美格鲁肽治疗使肾周脂肪和肾窦脂肪体积分别减少25%和13%(均P<0.05,图2)[1]。
既往研究证实,肾脏异位脂肪沉积会导致肾损害,其中肾周脂肪厚度是糖尿病肾病的独立预测因素,肾周脂肪每增加1个标准差,CKD风险增加67%[7,8];肾窦脂肪作为与肾血管紧密接触的特殊内脏脂肪,被发现与T2DM患者肾小球滤过率降低和肾血管阻力增加有关[9]。T2DM合并CKD患者应用司美格鲁肽治疗后,肾周和肾窦脂肪体积均显著减少,提示这可能是其肾脏保护的重要机制之一。
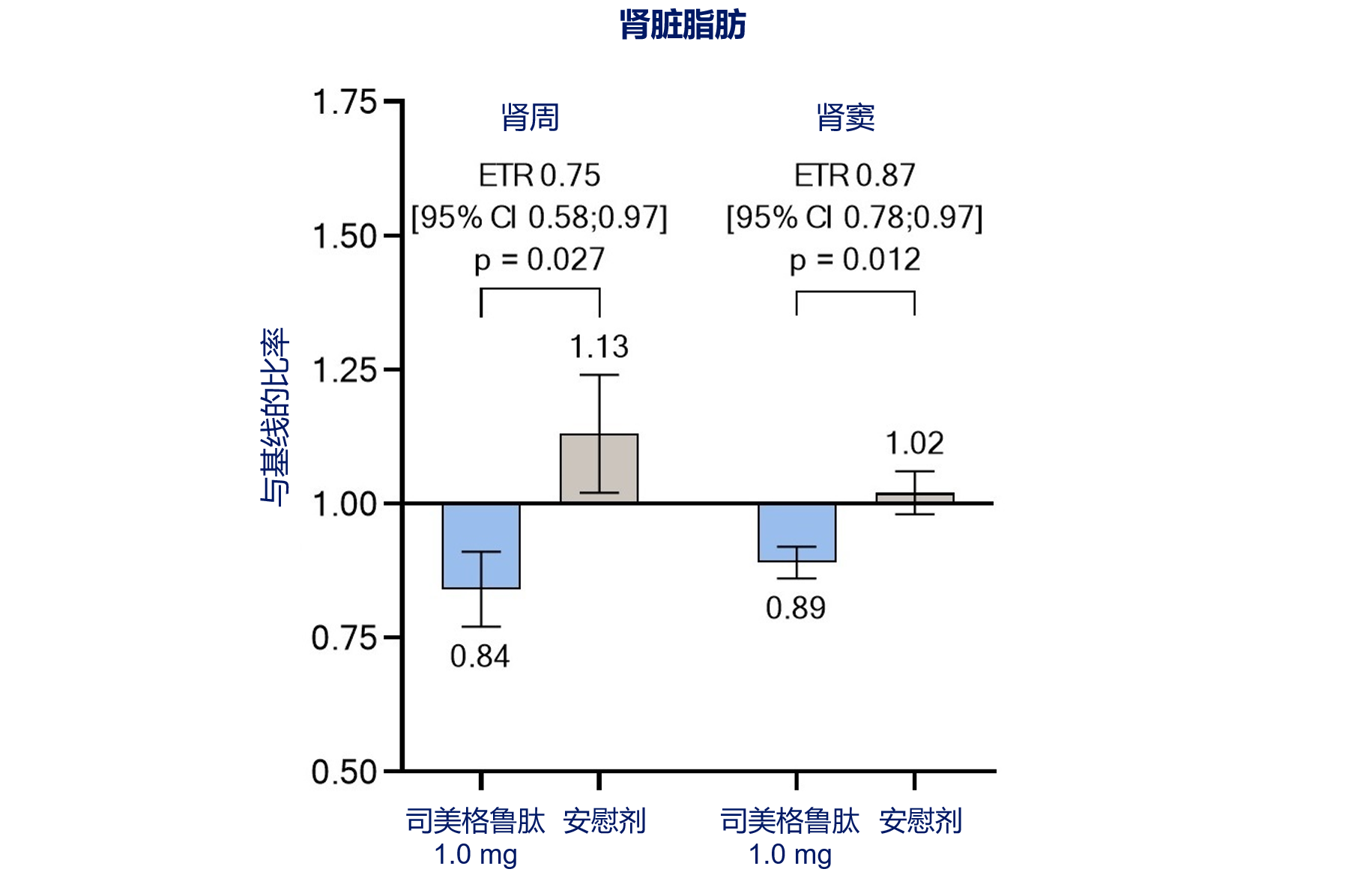
图2. 司美格鲁肽显著减少肾脏脂肪体积
02肾脏血管阻力显著降低
司美格鲁肽治疗较安慰剂显著降低肾动脉阻力指数(RARI),估计治疗比(ETR)为0.96(95%CI:0.93~0.99,P=0.008,图3)[1]。52周时,RARI较基线的变化趋势在安慰剂组是增加,而司美格鲁肽组则表现为下降。
RARI指标反映肾脏动脉血管床阻力、肾内血流灌注和动力学变化。糖尿病肾病患者病情进展与肾脏各级动脉血流动力学状态呈正比,RARI若高于0.7,即可判断糖尿病患者存在肾损害,可能已经发生糖尿病肾病[10]。该研究发现司美格鲁肽显著降低肾动脉阻力,支持其可通过改善血流动力学来发挥肾脏保护作用。
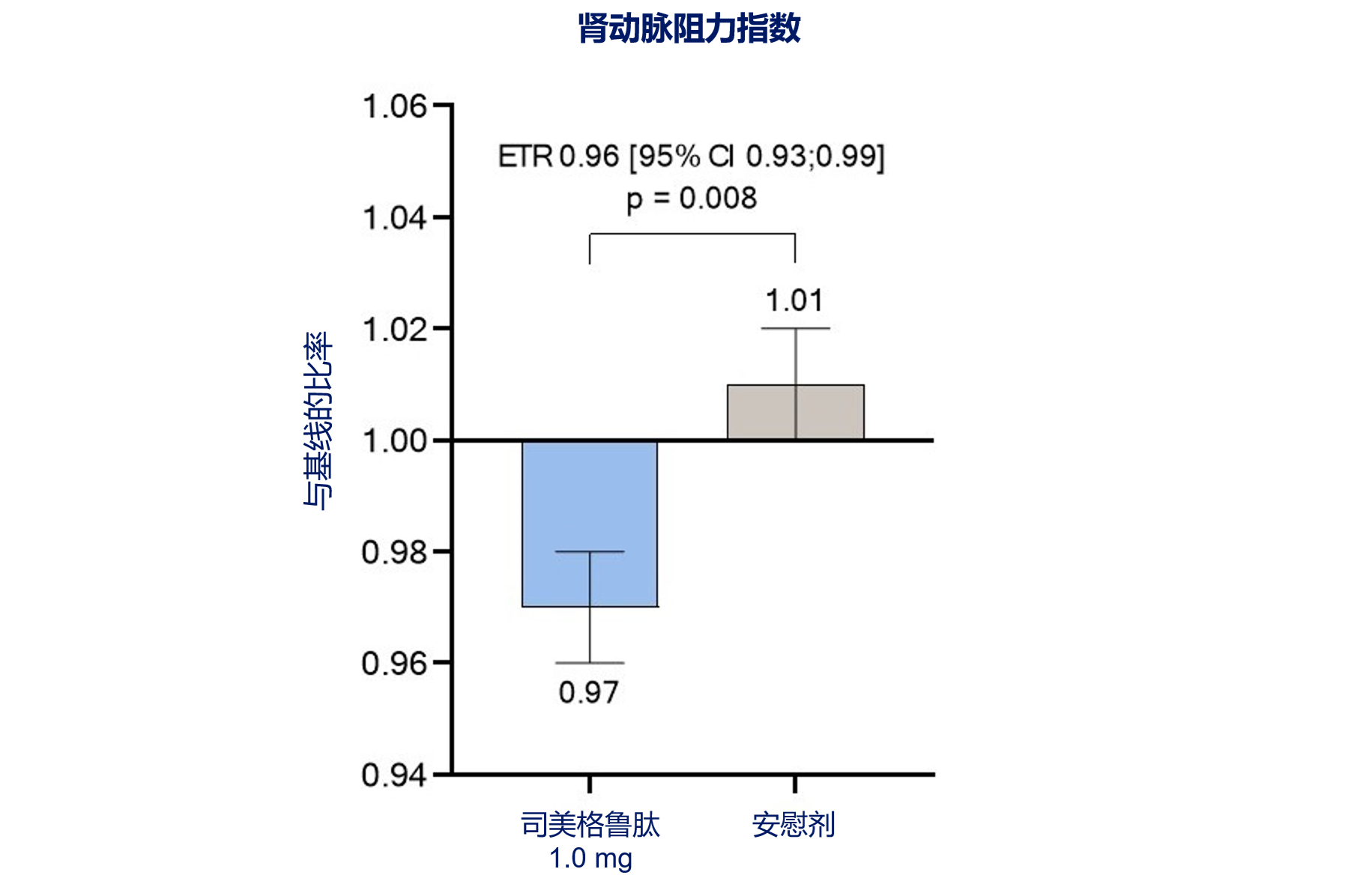
图3. 司美格鲁肽显著降低肾血管阻力
03肾脏纤维化指标保持稳定
司美格鲁肽治疗52周,肾皮质表观弥散系数(ADC)保持稳定,较基线无变化,而安慰剂组肾皮质ADC出现下降,组间差异具有统计学意义(ETR 1.05,95%CI:1.01~1.09,P=0.005,图4)[1]。
皮质ADC表示肾组织中的水运动,是反映肾脏纤维化的一个指标。纤维化可引起血管结构破坏和细胞外基质增殖,影响血流灌注和水运动,从而降低ADC。司美格鲁肽治疗期间,皮质ADC没有变化,提示T2DM合并CKD患者肾脏纤维化无明显进展。
图4. 司美格鲁肽稳定肾脏纤维化以上结果表明,在T2DM合并CKD患者中,司美格鲁肽可通过降低肾脏脂肪、改善血流动力学和稳定肾脏纤维化等机制来发挥肾脏保护作用。相应地,临床指标也支持司美格鲁肽对肾功能的改善作用,包括增加24h肌酐清除率12 ml/min、增加肾小球滤过分数19%、降低UACR达40%等[1]。
司美格鲁肽具有肾脏特异性保护机制,不仅仅依赖降糖、减重等代谢改善
目前认为,司美格鲁肽通过直接和间接等多种途径来实现肾脏获益。司美格鲁肽可显著改善多重代谢因素,包括降低HbA1c、减轻体重、降低血压和调节血脂谱等,有助于减轻肾脏负担,延缓肾病进展。REMODEL研究也再次证实司美格鲁肽的代谢调控作用,与安慰剂相比,其可使HbA1c显著降低0.9%、体重显著下降4.5 kg、收缩压下降4.0 mmHg[1]。
然而,代谢改善因素仅介导司美格鲁肽的部分肾脏保护效应。FLOW亚组分析证实,司美格鲁肽的肾脏获益不受基线BMI和体重变化的影响,中介分析显示体重减轻对主要肾脏事件获益的贡献甚微[11]。这提示,司美格鲁肽的直接肾脏保护作用可能更为突出,综合既往研究和REMODEL研究结果,具体机制包括抗炎抗纤维化、降低肾脏脂肪、促进尿钠排出、抑制肾素-血管紧张素-醛固酮系统(RAAS)、改善血流动力学等,司美格鲁肽通过多种机制共同作用来预防和延缓CKD发生发展[1,8]。
了解司美格鲁肽独特的肾脏保护机制,对于进一步改善T2DM合并CKD的治疗现状有着重要意义。正因为司美格鲁肽与其他肾心保护支柱药物的作用机理存在差异,才能更好地弥补现有短板,突破当前治疗困境。
三、 知其所必然:
司美格鲁肽有望成为T2DM合并CKD第四治疗支柱在T2DM合并CKD领域,司美格鲁肽的治疗地位正在不断提升。2024年CDS《中国糖尿病防治指南》和2025年ADA《糖尿病医学诊疗标准》,均一致推荐具有明确肾脏获益的GLP-1RA作为T2DM合并CKD治疗的一线药物[13,14]。近期,司美格鲁肽注射液在我国新增CKD适应症,为临床治疗糖尿病肾病提供新利器。
目前,RAAS抑制剂(RAASi)、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、非甾体类盐皮质激素受体拮抗剂(nsMRA)是T2DM合并CKD肾心保护的“三大支柱”,但患者仍面临较高的肾心残留风险。司美格鲁肽注射液在标准方案基础上进一步展现出挽救肾脏、心脏和生命的显著获益。基于明确的肾脏获益证据,以及与目前其他药物的不同肾脏保护机制,司美格鲁肽有望成为T2DM合并CKD的第四大治疗支柱,驱动糖尿病肾病治疗重大革新(图5)[15]。
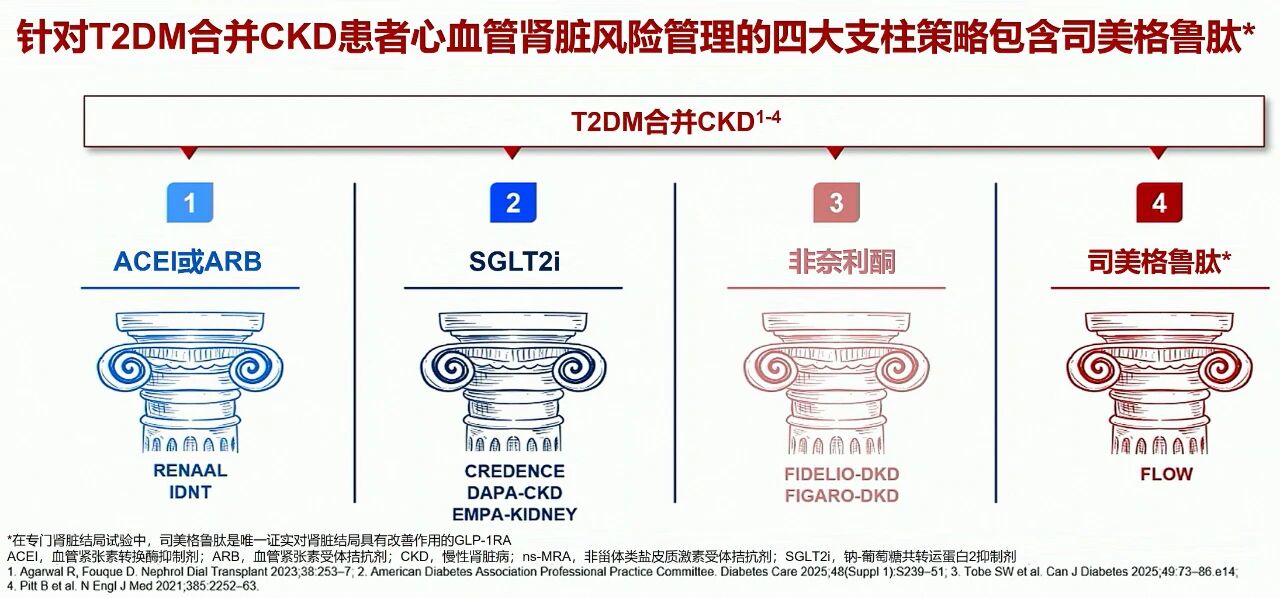
图5. 司美格鲁肽有望成为T2DM合并CKD的第四大治疗支柱
综上,基于肾脏结局研究的有力证据,以及独特的肾脏保护机制,GLP-1RA司美格鲁肽将深刻改变糖尿病肾病治疗格局。临床医生应充分了解司美格鲁肽的循证获益,并深刻理解其背后的作用机制,有利于将来在临床实践中更合理、积极地使用药物,造福患者。知其然,知其所以然,知其所必然!
参考文献
1. Tuttle KR, et al. Mechanistic Effects of Semaglutide on Kidney Disease in Type
2 Diabetes: The REMODEL Trial. Presented at Kidney Week 2025 in Houston, Texas, on November 7, 2025.2. Feng XS, et al. Kidney Med. 2021; 4(1): 100385.
3. Yang C, et al. Am J Kidney Dis. 2020; 76(2): 258-264.
4. Saran R, et al. Am J Kidney Dis. 2019; 73(3 Suppl 1): A7-A8.
5. Perkovic V, et al. N Engl J Med. 2024; 391(2): 109-121.
6. Cherney DZI, et al. Nephrol Dial Transplant. 2025; 40(11): 2182-2192.
7. 范笑忱, 等. 中华糖尿病杂志. 2025; 17(7): 914-918.
8. Chen X, et al. Diabetes. 2021; 70(10): 2322-2332.
9. Spit KA, et al. MAGMA. 2020; 33(1): 73-80.
10. 李楠, 等. 中华肾病研究电子杂志. 2019; 8(4): 186-189.
11. Johannes FE Mann. Impact of Semaglutide on Kidney, Cardiovascular, and Mortality Outcomes by Baseline BMI and Weight Loss in People with T2D and CKD - Data from the FLOW Trial. Presented at ADA2025 meeting. 1971-LB.
12. Alicic RZ, et al. Curr Opin Nephrol Hypertens. 2023; 32(4): 377-385.
13. 中华医学会糖尿病学分会. 中华糖尿病杂志. 2025; 17(1): 16-139.
14. ADA. Diabetes Care. 2025; 48(Suppl 1): S1-S352.
15. Paola Fioretto. Taking the next step: the role of GLP-1RAs in the CKD and T2D nexus. Presented at Symposium at EASD 2025 meeting. WEDNESDAY, 17 September 2025.
- 推荐文章
