- 首页 > 正文
北京大学人民医院肾内科多项研究亮相ASN 2025,一项研究入选LBCT
发表时间:2026-01-31 15:40:43
在2025年美国肾脏病学会(ASN)年会期间,来自中国的多项研究被选中参与Late-breaking环节、壁报环节的学术交流。北京大学人民医院肾内科携多项研究成果亮相,本文予以介绍。
为期52周的Ⅲ期研究:新型铁基磷结合剂AP301有效降低透析伴高磷血症患者的血清磷,且安全性良好
【TH-PO1200】52-Week Phase 3 Study to Evaluate the Efficacy and Safety of a Novel Iron-Based Phosphate Binder AP301 in Patients on Dialysis with Hyperphosphatemia第一作者:左力
A
P301是一种新型非吸收性铁基磷酸盐结合剂,无需咀嚼服用。北京大学人民医院左力等开展一项为期52周的Ⅲ期临床试验,评估了AP301治疗透析相关性高磷血症患者的疗效和安全性。该试验入选ASN2025的“Late-Breaking Research”,以壁报形式在大会上展示。
该研究为阳性对照试验(临床试验注册号:NCT07030595),纳入474例基线血清磷(s-P)水平为6.0~10.0 mg/dl的血液透析及腹膜透析患者,按3:1比例随机分配至AP301组(2.1~9.1 g/d)或碳酸司维拉姆组(SEV,2.4~9.6 g/d)。两组均为每日三餐后给药(TID),通过剂量滴定维持血清磷水平在3.5~5.5 mg/dl。第24周时达到AP301应答标准(血清磷<5.5 mg/dl)的患者,按1:1比例再次随机分配至维持剂量组(MD)或无效低剂量组(LD,0.375 g/d),持续3周(图1)。研究主要终点包括:第12周时AP301相对于SEV的非劣效性,以及第24~27周随机撤药阶段中AP301维持剂量相对于低剂量在血清磷控制方面的优效性;次要终点为安全性与耐受性。
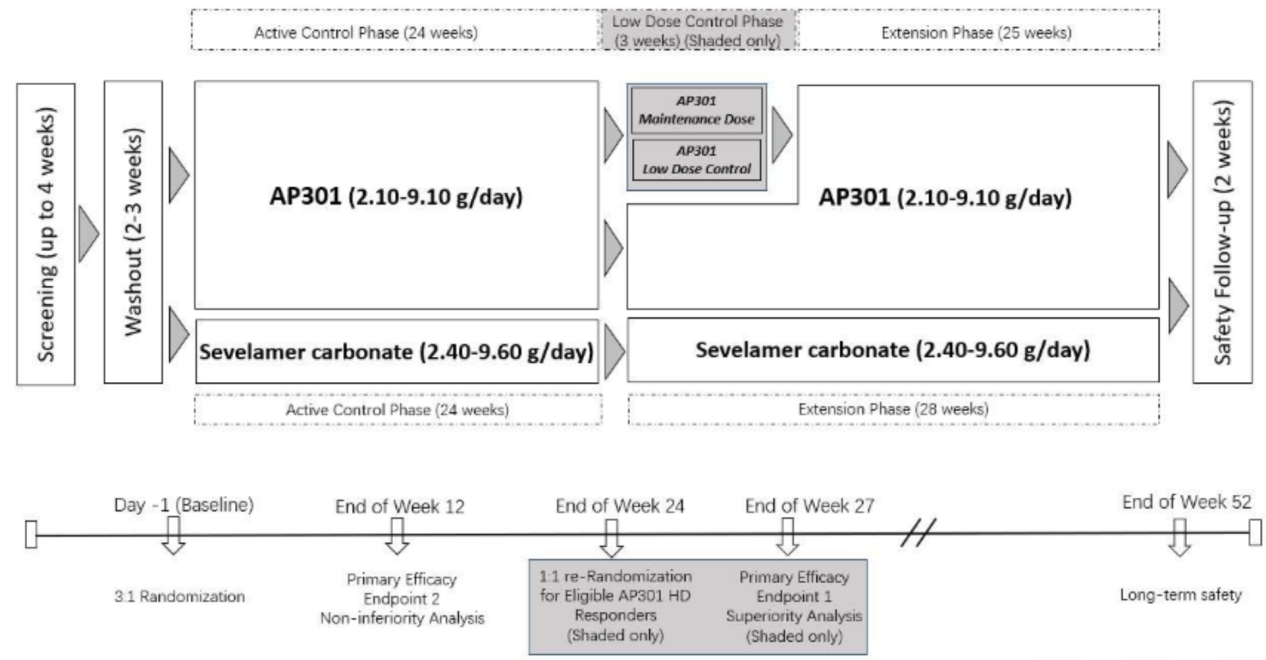
图1. 研究设计(引自报告幻灯)
最终396例(84%)完成研究。第12周时,AP301组与SEV组的血清磷较基线平均变化(±标准误)分别为-2.2±0.1 mg/dl和-2.2±0.1 mg/dl,显示AP301具有非劣效性(95%CI上限0.19 mg/dl,低于预设非劣效界值0.59 mg/dl)(图2)。第27周时,主要终点结果显示维持剂量组相对于低剂量组具有临床显著优效性(最小二乘均数差异-1.8 mg/dl,95%CI:-2.1~-1.5;P<0.001)(图3)。AP301的疗效持续维持至第52周。
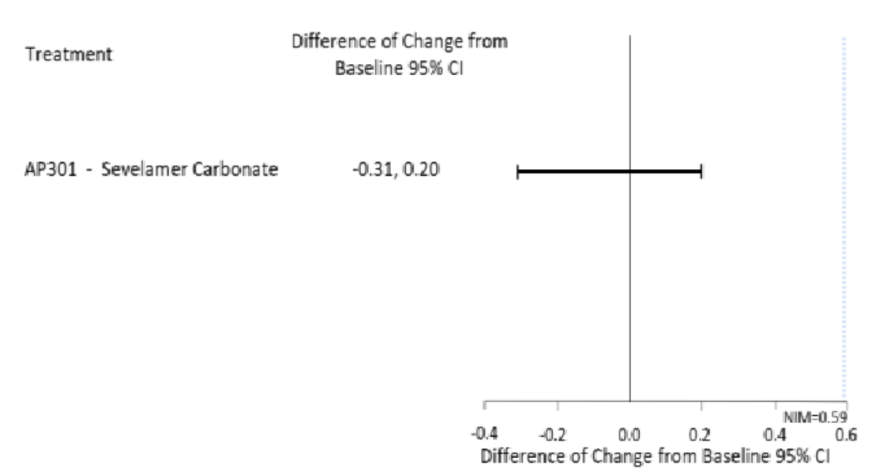
图2. 12周时血清磷较基线的平均变化(引自报告幻灯)
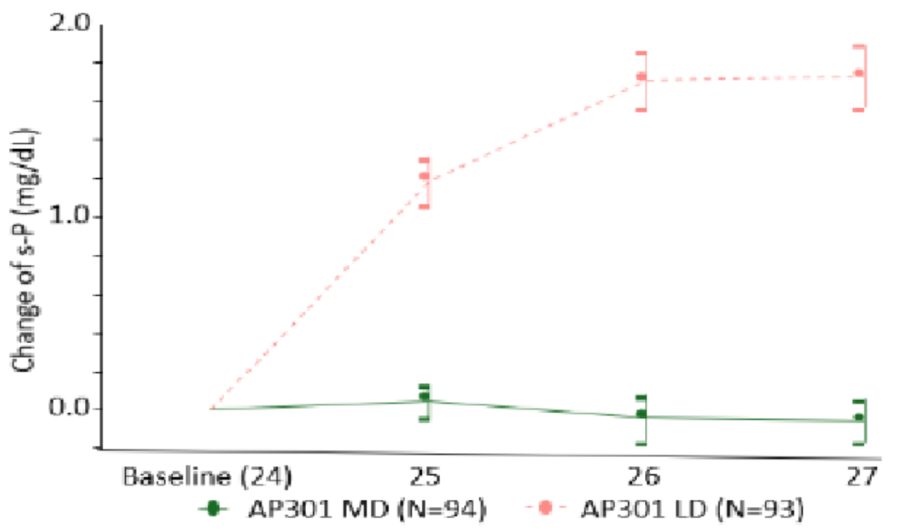
图3. 24~24周时低剂量期血清磷的变化(引自报告幻灯)
两组治疗期间不良事件(TEAEs)发生率相近(AP301组96.3%,SEV组90.8%)。AP301组更常见粪便变色(33.8%)和腹泻(17.2%),且多为早期发作;SEV组则以恶心(4.2%)和便秘(3.4%)更为多见。至第24周,患者铁代谢指标出现轻度、无临床意义的变化,未观察到铁蓄积证据。
结论
新型铁基磷酸盐结合剂AP301能有效降低透析相关性高磷血症患者的血清磷水平,且安全性与耐受性良好。
中国血液透析患者高血压临床特征分析:各中心高血压管理仍存在显著差异
【FR-PO0439】Hypertension Clinical Profile in Chinese Patients on Hemodialysis: A Multicenter, Retrospective, Cross-Sectional Study第一作者:Liangying Gan
血液透析(HD)患者的高血压患病率超90%。作为明确的心血管危险因素,高血压在该人群中需得到高度关注与规范管理——心血管疾病仍是血液透析患者的首要死亡原因。目前,针对血液透析患者高血压管理的临床实践指南尚属空白,导致各中心临床诊疗存在显著异质性。本研究为多中心、回顾性、横断面研究,旨在调查中国血液透析患者高血压治疗与管理现状,为提高血压(BP)控制率、降低心血管事件发生率及死亡率提供基础数据支持。
研究共纳入20个省份的68家血液透析中心,各中心中位入组患者数为175例。动态血压监测(ABPM)的中心使用率仍处于较低水平(历史数据与当前数据分别为6.7%和6.8%),家庭血压监测(HBPM)的中心使用率分别为37.4%(历史)和35.9%(当前)。所有中心均开展透析前血压测量。各中心的血压控制目标详见表1。根据各中心制定的诊断标准,74.6%的患者达到“满意”血压控制。近期透析前及透析后收缩压控制情况总结于表2。降压药物使用模式与三年前基本一致。
表1. 根据测量方法划分的血压控制目标(引自大会摘要)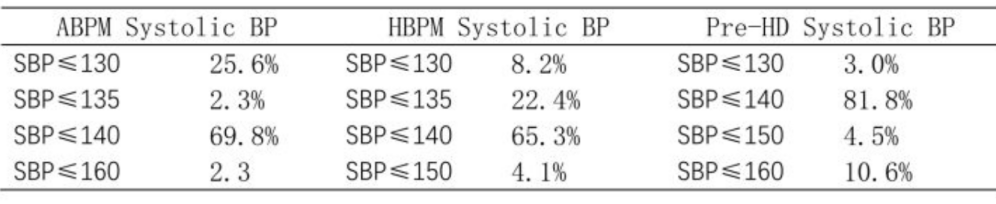
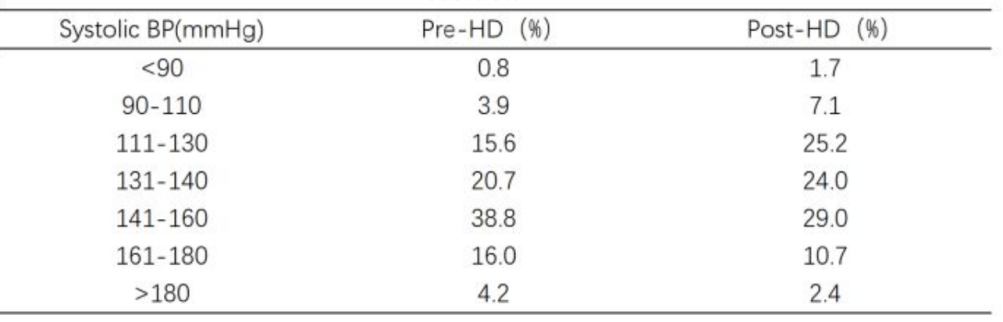
中国血液透析患者的血压管理实践在各中心间仍存在显著差异,且过去三年间改善甚微。这些结果凸显了制定标准化临床实践指南的迫切需求,以优化该高危人群的血压管理。
培莫沙肽通过调控EPOR-CD131依赖的JAK2/STAT3信号通路改善硫酸吲哚酚诱导的心肌细胞肥大
【TH-PO0288】Pegmolesatide Ameliorates Indoxyl Sulfate-Induced Cardiomyocyte Hypertrophy Through Modulating the EPOR-CD131-Dependent JAK2/STAT3 Signaling Pathway第一作者:Xinyu Zhang
心血管事件仍是慢性肾脏病(CKD)患者的首要死亡原因。培莫沙肽(Pegmolesatide,P)作为一种新型长效促红细胞生成素受体调节剂,在临床研究中已显示出心血管保护获益。本研究旨在验证培莫沙肽对EPOR-CD131异二聚体形成的抑制作用,并探讨其在硫酸吲哚酚(IS)诱导的心肌细胞肥大中的心脏保护机制。
将H9c2心肌细胞分为表型实验组(溶剂对照组、IS组、IS+P组、P组),通过RNA测序筛选差异调控的信号通路;机制探索组额外加入CD131激动剂ARA290、STAT3激活剂Colivelin或STAT3抑制剂Stattic进行拯救实验。采用实时荧光定量聚合酶链反应(realtime-qPCR)/蛋白质印迹法(Westernblot)检测心肌肥大标志物及EPOR-CD131/JAK2/STAT3通路组件的表达水平,鬼笔环肽染色观察细胞大小,免疫共沉淀(Co-IP)技术检测EPOR-CD131异二聚体的形成情况。
培莫沙肽可减轻IS诱导的心肌细胞肥大,具体表现为:心肌肥大标志物(心钠肽ANP、脑钠肽BNP、β-肌球蛋白重链β-MHC)的表达受抑,细胞表面积减小,细胞骨架排列改善(P<0.05)。机制层面,培莫沙肽可上调EPOR表达,同时抑制CD131表达及JAK2/STAT3信号通路的激活;免疫共沉淀结果证实,培莫沙肽能抑制EPOR-CD131异二聚体的形成。拯救实验显示,CD131激动剂ARA290或STAT3激活剂Colivelin可逆转培莫沙肽的心脏保护作用;值得注意的是,ARA290与STAT3抑制剂Stattic联合处理可部分恢复培莫沙肽的抗肥大活性。
结论
培莫沙肽通过抑制EPOR-CD131/JAK2/STAT3信号轴,对IS诱导的心肌细胞肥大发挥保护作用,有望成为CKD相关心血管并发症的潜在治疗策略。
慢性肾脏病贫血治疗的患者与肾内科医生偏好:基于离散选择实验(DCE)的全国多中心调查问卷预调查结果
【FR-PO0220】Anemia in CKD: Results from a Presurvey of a Nationwide Multicenter Survey Questionnaire Based on a Discrete Choice Experiment (DCE)第一作者:Qingyu Niu
贫血是慢性肾脏病(CKD)的常见并发症。目前的治疗方案包括促红细胞生成素类药物、缺氧诱导因子脯氨酰羟化酶抑制剂、促红细胞生成素模拟肽等,给药频率存在差异(例如:口服每日1次、每周3次;皮下注射每周3次、每2周1次、每月1次)。本研究旨在评估患者与肾内科医生对肾性贫血治疗的偏好。
本全国多中心研究通过文献回顾、访谈及三轮预调查,制定了离散选择实验(DCE)问卷。预调查结果来自中国不同地区的7家大型综合医院;最终研究将纳入800名肾内科医生与3000例患者,以报告其对贫血治疗的偏好。
预调查队列包含15名肾内科医生与45例患者,调查结果显示:
肾内科医生的关键偏好决定因素包括药物疗效、适应证、禁忌证、患者依从性、成本等;
与医生相比,患者更重视症状改善及给药方式;
给药方式与频率是医患共同关注的要点:部分患者会尽量减少皮下注射频率(如使用每月1次的长效皮下制剂),或选择更频繁的口服方案以避免注射疼痛。
结论
本研究通过离散选择实验(DCE)设计,优化慢性肾脏病贫血的个体化管理。研究者认为,这项基于DCE的全国多中心调查将为贫血治疗偏好提供更多证据支持。
新型缺氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)AND017用于非透析依赖型慢性肾脏病(NDD-CKD)贫血患者的Ⅲ期研究即将开展
【INFO20-TH】Phase 3 Study of AND017, a Hypoxia-Inducible Factor-Prolyl Hydroxylase Inhibitor (HIF-PHI), in Patients with Anemia Due to Nondialysis-Dependent CKD (NDD-CKD)第一作者:Yusha Zhu
AND017是一种新型缺氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)。既往在中国和美国患者中完成的AND017的Ⅱ期研究已经显示,AND017可有效提升并维持血红蛋白(Hb)水平在目标范围内,且Hb上升速率显著高于安慰剂,且AND017的安全性良好,未出现特殊安全信号。这些发现为AND017的给药方案与剂量调整规则提供了依据。
北京大学第一医院肾内科计划开展AND017的多中心、随机、开放标签、阳性对照、Ⅲ期试验,旨在NDD-CKD贫血患者中评估AND017与阳性对照药物(促红细胞生成素类药物,ESA)的疗效和安全性。
研究拟纳入约240例患者,按2:1比例随机分配至AND017组或ESA组:
初始治疗期为26周,之后AND017组所有患者将进入26周的延长期,以进行长期随访;
入组人群包括未使用过ESA的患者(筛查Hb水平7.5~10.0 g/dl)与已使用过ESA的患者(筛查Hb水平9.0~12.0 g/dl);
AND017的起始剂量:未使用过ESA的患者为每周3次(TIW)、每次8 mg;已使用过ESA的患者为每周3次、每次10 mg。当患者Hb水平达到方案指定的理想范围后,给药频率将调整为每周1次(QW);整个研究期间,AND017的剂量将根据Hb水平以4 mg为增量调整(可维持每周3次或调整为每周1次)。
主要疗效终点为初始治疗期第23~27周的平均Hb水平。若平均Hb的单侧95%置信区间下限≥-1.0 g/dl,则可证实AND017不劣于ESA治疗。该方案已通过中国国家药品监督管理局(NMPA)审核,是AND017在中国用于CKD贫血治疗的关键Ⅲ期试验。
- 推荐文章
