- 首页 > 正文
肾例明鉴|男子治疗肾病综合征,为何又添肺栓塞?雪上加霜需警惕,比肾病本身更可怕
发表时间:2026-02-02 10:30:13
编者按
静脉血栓栓塞症是肾病综合征的常见并发症,包括深静脉血栓和肺血栓栓塞症。由于临床症状不典型甚至无临床症状,因此肾病综合征合并静脉血栓栓塞症的漏诊率、误诊率很高。肺栓塞是心血管系统的急症,可引起危及生命的右心衰竭。正确诊断、及时治疗对肾病综合征并发肺栓塞的预后至关重要。

一、临床资料
男性,49岁。主诉:发现蛋白尿1年3个月,水肿1个月余。
既往史:脂肪肝6年余。
入院查体:T 36.1℃,P 72次/分,R 18次/分,BP 120/70mmHg。全身浅表淋巴结无肿大。无皮疹。双肺呼吸音清,未闻及干湿啰音。心界不大,心率72次/分,心律齐,P2无亢进。腹软无压痛、反跳痛、肌紧张,移动性浊音(-),双下肢轻度水肿。
辅助检查:尿常规示蛋白(++++),RBC 0~1/HP,24小时尿蛋白定量(UTP)5.58g/d,血ALB 26.5g/L,SCr 80μmol/L,尿素(Urea)4.72mmol/L,总胆固醇(TCHO)6.71mmol/L,甘油三酯(TG)2.76mmol/L,肝功能及血糖正常。血IgG 6g/L,IgA、IgM、C3及C4均正常。血尿免疫固定电泳未见单克隆免疫球蛋白或轻链,HBsAg和抗-HCV均阴性,ANA、ENA谱、抗dsDNA、ANCA及抗GBM抗体均阴性。CEA、CA-199及AFP均正常。腹部超声检查双肾大小正常,无肾积水;腹部其他脏器未见异常,无腹水。心电图正常。双下肢彩超检查未见静脉血栓。
二、临床诊治经过
患者中年男性,临床符合肾病综合征。无感染(如HBV和HCV)、代谢性疾病(如糖尿病)、肿瘤性疾病(如骨髓瘤)和原发淀粉样变等继发疾病证据。因此考虑原发性肾病综合征可能性大。结合年龄及隐匿起病特点,考虑膜性肾病可能性大。于入院第4天行肾穿刺活检,病理结果示Ⅱ期膜性肾病。肾活检1周后患者逐渐出现咳嗽、痰中带少量血丝,突发胸闷、憋气,血压正常,ECG未见明显异常,SpO2 90%、D-二聚体2.55mg/L。结合病史,高度怀疑肺栓塞。行CTPA示左肺动脉主干可见大块肺血栓栓塞(图1),右肺动脉可见较小的血栓。
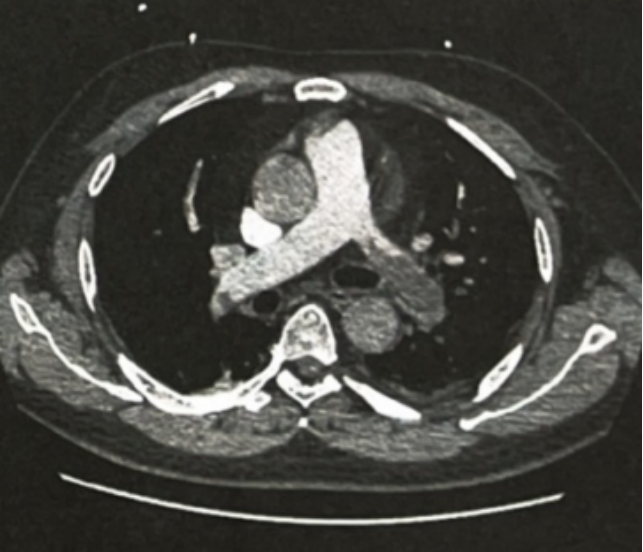
图1. CTPA
床旁UCG示右室偏大,室间隔运动略僵硬,肺动脉收缩压35mmHg,肺栓塞诊断明确。予r-tPA 100mg溶栓,序贯予低分子肝素钙注射液及华法林抗凝治疗,患者胸闷、咯血、咳嗽等症状逐渐消失。同时给予泼尼松联合环孢素A治疗肾病综合征半年,其间环孢素A的浓度维持在125~175ng/ml,肾病综合征一直没有缓解,遂停药。复查UTP 7~10g/d,ALB 16~18g/L,换用泼尼松联合环磷酰胺治疗。其间持续服用华法林,维持INR 2.0~2.8。2个月后患者UTP 3.5g/d,ALB 28g/L,泼尼松减量。3个月后患者UTP 2.1g/d,ALB 32g/L,泼尼松继续减量;环磷酰胺累积剂量达到9g后停药;拟继续服药华法林6个月。
最终诊断:肾病综合征;Ⅱ期膜性肾病;慢性肾脏病Ⅰ期;急性肺栓塞;脂肪肝。
三、讨论
这是一例肾病综合征合并肺栓塞的病例。肾病综合征是一种常见的肾脏临床综合征,其诊断标准主要包括蛋白尿、低蛋白血症、高脂血症和水肿等异常临床表现。肾病综合征患者是深静脉血栓及肺栓塞的高风险人群,而各种原发性肾病综合征病因中膜性肾病(MN)的血栓栓塞风险最高。一项纳入898例病理证实的MN患者的队列研究显示深静脉血栓发生率为7.2%,发生中位时间是诊断后的3.8个月。一项针对儿科100例MN肾病的前瞻性研究发现肺栓塞的发生率为17%。约半数肺栓塞患者没有临床症状。但是如果未经及时诊断及适当治疗,无症状性肺栓塞可能会进展至有症状或者致命性肺栓塞,应引起肾内科医生重视[1,2]。
研究证实,肾病综合征患者由于大量蛋白尿、低白蛋白血症、脂质代谢紊乱,体内凝血、抗凝及纤溶系统紊乱,存在高凝倾向,易致血栓形成。其机制涉及以下几个方面:(1)凝血系统的激活:肾病综合征时由于血脂、肾小球滤过膜通透性的增加以及继发性肝脏合成功能的改变,凝血因子发生改变。凝血因子V、VⅢ以及血浆von Wille-brand因子、纤维蛋白原、α2巨球蛋白合成增加。纤维蛋白原水平增高,为交联纤维蛋白的形成提供更多的底物,同时为血小板聚集提供了桥梁,增加血液黏度,促进红细胞聚集,促进高凝状态的发生。(2)抗凝和纤溶系统紊乱:40%~80%的肾病综合征患者循环抗凝血酶Ⅲ水平降低。蛋白C的活性和蛋白S的含量下降。(3)血小板功能亢进:实验研究发现肾病综合征患者相比于健康人外周血循环中的P-选择素增加,提示血小板活化在其高凝状态中可能发挥一定的作用。其机制可能是低白蛋白血症增加了花生四烯酸的利用度。低白蛋白血症状态下,花生四烯酸与白蛋白结合减少,在环氧合酶-1作用下,转化为血栓烷A2增多,血栓烷A2对血小板聚集有促进作用[3,4]。
文献中没有单独研究肾病综合征合并肺栓塞的高危因素的报告,但是肺栓塞是深静脉血栓(DVT)的常见合并症,约占56%。因此凡是DVT的高危因素都可以认为是肾病综合征合并肺栓塞的高危因素,包括:①血浆白蛋白低于20g/L。一般肾病综合征患者ALB<20g/L时即有高凝状态,易出现DVT。②MN。MN 患者在更高的血白蛋白阈值水平DVT的发生风险就明显增加。有学者研究发现,MN血白蛋白<25g/L者静脉血栓的发生率为40%,而白蛋白>25g/L者发生率仅为2.7%。也有学者研究提示,MN患者血清白蛋白浓度<28g/L患者与>28g/L的患者相比,静脉血栓风险明显增高2.5倍(9.4%比3.2%)。在该阈值以下,血清白蛋白每下降10g/L,风险增加2.13倍。少数患者即使在血浆白蛋白正常的情况下仍可出现肺栓塞。③不适当的利尿治疗。不适当的利尿治疗可促使血液浓缩,加重高凝状态,促使血栓形成。④其他因素:包括遗传性S蛋白、C蛋白缺乏、抗磷脂抗体综合征、糖皮质激素治疗、制动等因素[5,6]。
鉴于多数肾病综合征合并肺栓塞者没有相应的临床症状,而且DVT、膜性肾病和严重低白蛋白血症为肺栓塞的主要高危因素,因此针对这些患者即使没有症状,在确诊肾病综合征后应该常规进行DVT的筛查,包括检测血FDP、D-二聚体水平,彩色多普勒超声进行下肢深静脉与肾静脉检查。DVT或者肺栓塞诊断的“金标准”是静脉造影(VG)。但VG是侵入性检查且价格昂贵,可引起静脉炎、感染、造影剂过敏、对比剂肾病、出血、血栓脱落等,需谨慎选择。随着静脉超声技术的发展和普及,超声造影检查CUS因具有无创,可重复,检查便捷,且灵敏度、特异度、准确性高等优点,已逐渐取代VG成为DVT确诊检查的首选。CUS在妊娠患者中的灵敏度和特异度都>95%。CT静脉造影和核素静脉显像可作为DVT的补充检查手段,但需进一步研究验证其特异度和灵敏度。
对于没有发现血栓栓塞证据的患者,目前尚没有针对肾病综合征预防性抗凝获益及风险的对照研究证据。对于血白蛋白<20g/L的非MN肾病综合征及血白蛋白<25g/L的MN且低出血风险患者,通常建议给予预防性抗凝治疗,直至高风险因素得到控制,如血白蛋白增高到30g/L以上。对于存在新发血栓栓塞患者,在确诊后立即开始抗凝治疗直至肾病综合征缓解后至少6个月,通常给予肝素或低分子肝素,随后转换至华法林,目标INR为2.0~3.0。溶栓治疗仅针对发生严重血流动力学变化的急性肺栓塞[7,8]。
本例肾病综合征患者经肾活检确诊为膜性肾病。入院时没有血栓栓塞证据,且血浆白蛋白>25g/L,因此没有进行常规预防性抗凝治疗。但是在诊疗过程中仍然发生肺栓塞,可能与膜性肾病病理类型、肾活检后制动等诱因有关。患者肺栓塞未导致显著血流动力学改变,仅给予抗凝治疗。随着针对MN的治疗,患者肾病综合征部分缓解后血白蛋白升高至>30g/L时认为肾病综合征导致的高凝风险已消失,因合并血栓栓塞并发症,需要继续抗凝6个月。
参考文献
[1] Barbour SJ, Greenwald A, Djurdjev O, et al. Disease-specific risk of venous thromboembolic events is increased in idiopathic glomerulonephritis.Kidney Int. 2012;81(2):190-195.
[2] Zhang LJ, Wang ZJ, Zhou CS, Lu L, Luo S, Lu GM. Evaluation of pulmonary embolism in pediatric patients with nephrotic syndrome with dual energy CT pulmonary angiography.?Acad Radiol. 2012;19(3):341-348.
[3] Gigante A, Barbano B, Sardo L, et al. Hypercoagulability and nephrotic syndrome.Curr Vasc Pharmacol. 2014;12(3):512-517.
[4] Tian Y, Sun B, Sun G. Research progress of nephrotic syndrome accompanied by thromboembolism.?Int Urol Nephrol. 2023;55(7):1735-1745.
[5] Lionaki S, Derebail VK, Hogan SL, et al. Venous thromboembolism in patients with membranous nephropathy.?Clin J Am Soc Nephrol. 2012;7(1):43-51.
[6] Li SJ, Guo JZ, Zuo K, et al. Thromboembolic complications in membranous nephropathy patients with nephrotic syndrome-a prospective study.Thromb Res. 2012;130(3):501-505.
[7] De Pascali F, Brunini F, Rombolà G, Squizzato A. Efficacy and safety of prophylactic anticoagulation in patients with primary nephrotic syndrome: a systematic review and meta-analysis.Intern Med J. 2024;54(2):214-223.
[8] Kelddal S, Nykj?r KM, Gregersen JW, Birn H. Prophylactic anticoagulation in nephrotic syndrome prevents thromboembolic complications.BMC Nephrol. 2019;20(1):139. Published 2019 Apr 25.
- 推荐文章
