- 首页 > 正文
毛建华教授团队综述:抗B细胞治疗在肾病综合征中的新进展——超越利妥昔单抗
发表时间:2026-02-02 11:25:21

B细胞在NS发病机制中扮演多重角色,主要包括以下四个方面(图1):
1. 产生自身抗体
B细胞通过产生自身抗体攻击肾小球滤过屏障的关键成分,如nephrin和UCHL1等抗原,导致滤过屏障破坏,蛋白尿形成。研究发现,抗nephrin自身抗体和抗UCHL1抗体与微小病变型肾病(MCD)和特发性NS的疾病活动密切相关。
2. 参与细胞免疫反应
B细胞作为抗原呈递细胞,通过MHC-Ⅱ分子和共刺激信号激活CD4+T细胞,促进Th1、Th2、Th17等效应T细胞亚群的活化。B细胞与T细胞、巨噬细胞等免疫细胞相互作用,形成炎症放大网络,进一步损伤肾小球。
利妥昔单抗通过清除B细胞改善病情:减少自身抗体产生、间接抑制T细胞过度激活、恢复Treg/Th17平衡并调节巨噬细胞极化。B细胞—T细胞—巨噬细胞的相互作用是特发性NS免疫病理机制的核心,为治疗干预提供了新的靶点。
3. 调节免疫稳态
调节性B细胞(Bregs)在维持免疫耐受中起关键作用。NS患者中Bregs数量或功能异常,导致炎症通路激活,如Th17细胞增多、Treg细胞减少,进一步加剧肾小球损伤。研究表明,B细胞产生的细胞因子在NS发病机制中的关键作用已超出其传统免疫功能范畴。以IL-6、TNF-α和BAFF持续信号传导为特征的致病性细胞因子网络,不仅会加剧足细胞损伤,也是激素抵抗性肾病综合征(SRNS)患者出现治疗抵抗的重要原因,这为B细胞靶向清除治疗提供了充分依据。
4. 促进肾小球硬化
B
细胞参与肾小球硬化进展。肾小球硬化是一种以肾小球硬化和瘢痕形成为特征的病理状态,是肾功能下降的重要原因。肾小球硬化可损害肾小球的血液滤过能力,CKD可进展至终末期肾病,肾小球滤过率低于15 ml/(min·1. 73m²),通常需要透析或肾移植治疗。
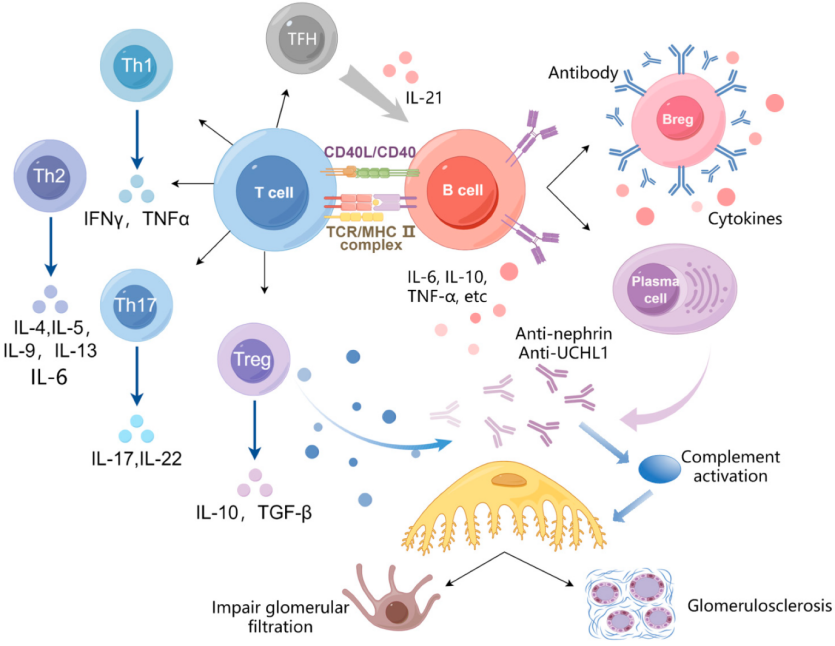
图1. NS中B细胞可能的病理机制(B细胞通过四种关键机制驱动NS发病机制:自身抗体介导的足细胞损伤[抗肾上腺素、抗UCHL1]、免疫复合物形成和补体激活、促炎细胞因子产生[IL-6、IL-10、TNF-α等]和调节性B细胞功能的破坏)
二、创新的B细胞靶向治疗
1. 利妥昔单抗(Rituximab)
作为第一代抗CD20单抗,利妥昔单抗通过抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)和诱导凋亡等机制清除B细胞。多项研究证实其在儿童和成人频繁复发型/激素依赖型NS中能显著延长无复发生存期,减少激素和CNIs的使用。然而,其疗效在局灶节段性肾小球硬化(FSGS)和部分难治性病例中有限,且存在免疫原性、组织B细胞清除不完全、低球蛋白血症和感染风险等问题。
2. 奥法木单抗(Ofatumumab)
奥法木单抗为全人源化抗CD20单抗,可结合CD20抗原上的独特表位,通过CDC和ADCC机制诱导B细胞裂解;通过选择性清除CD20+B细胞,阻断参与疾病发病的炎症过程(如自身抗体产生和T细胞活化)。其皮下注射剂型便于患者居家使用。
研究表明,奥法木单抗在利妥昔单抗耐药的部分NS患者中仍可诱导缓解,并可能是难治性儿童肾病综合征的可行治疗方案。但对于激素和CNIs双重依赖的儿童肾病综合征患者,奥法木单抗单药治疗并未显示出优于利妥昔单抗。而在多药耐药型NS中,奥法木单抗低剂量(1500 mg/1.73m²)疗效有限,高剂量方案(先给予300 mg/1.73m²,随后给予5次2000 mg/1.73m²)可能带来更好效果但需关注安全性。
3. 奥妥珠单抗(Obinutuzumab)
作为Ⅱ型抗CD20单抗,奥妥珠单抗经糖基化改造增强抗体依赖性细胞毒性(ADCC)效应,B细胞清除能力优于利妥昔单抗。其在成人MCD/FSGS和儿童SDNS/FRNS中显示出更持久的B细胞清除和更长的无复发生存期,安全性良好,成为利妥昔单抗耐药或不耐受患者的潜在替代选择。
4. 乌妥昔单抗(Ublituximab)
乌妥昔单抗是一种新型嵌合抗CD20单抗,对FcγRIIIa亲和力更高,ADCC效应更强。目前其在多发性硬化症和血液肿瘤中显示疗效,但在肾脏疾病中的应用数据尚少,潜力值得进一步探索。
三、靶向浆细胞的治疗策略
浆细胞作为抗体主要来源,其表面高表达CD38分子,成为治疗自身抗体介导性肾病的重要靶点。
达雷妥尤单抗是一种抗CD38单抗,通过ADCC、CDC、ADCP和直接诱导凋亡等多种机制清除致病性浆细胞,同时也会影响CD38阳性免疫细胞(如调节性B细胞、髓系来源抑制细胞,以及近期发现的免疫抑制性CD38+调节性T细胞亚群)。除上述免疫介导机制外,达雷妥尤单抗还可通过Fc-FcγR通路与巨噬细胞相互作用发挥抗肿瘤活性
研究显示,达雷妥尤单抗在难治性狼疮性肾炎(LN)、抗体介导的肾移植排斥反应(AMR)和膜性肾病(MN)中均显示出良好疗效。例如,在6例难治性LN患者中,5例在接受达雷妥尤单抗治疗后获得临床和血清学改善。
联合治疗策略:由于B细胞和浆细胞在疾病中共同作用,联合抗CD20与抗CD38治疗(如利妥昔单抗+达雷妥尤单抗)在难治性NS中显示出协同效应。一项针对儿童和青年SRNS的Ⅱ期研究(DUAL-1)正在进行中,旨在评估该联合方案在维持无药缓解方面的潜力。研究表明,IgM水平降低和CD38+浆细胞减少与疾病缓解相关,提示这些细胞和抗体可能参与NS的病理过程。此外,研究还提示,达雷妥尤单抗可能通过作用于长寿浆细胞,在B细胞恢复后仍能维持疾病缓解状态。奥滨尤妥珠单抗联合达雷妥尤单抗治疗,可有效实现难治性激素依赖性肾病综合征(SDNS)患者的长期B细胞清除和疾病缓解。
C
D38单克隆抗体相关的主要不良反应包括:①输液相关反应(IRR),如发热、寒战、呼吸困难;②血液系统毒性,如中性粒细胞减少、贫血、低丙种球蛋白血症;③感染风险升高。此外,这类药物还可能引发免疫介导效应(如T细胞活化),进而导致自身免疫现象或移植物抗宿主病。
四、CAR-T细胞疗法
CAR-T细胞疗法通过基因工程改造患者T细胞,使其表达一种人工合成的受体,并靶向B细胞表面抗原(如CD19、BCMA)的嵌合抗原受体,该受体由以下四个部分构成:①胞外结构域:源于单克隆抗体的单链可变片段(scFv),可实现对CD19、BCMA等抗原的特异性识别;②铰链/间隔区:源于CD8、IgG4等分子的序列,为受体提供必要的灵活性,确保抗原的最佳结合效果;③跨膜结构域:源于CD28、CD3ζ等分子,负责将CAR锚定在T细胞膜上;④胞内信号结构域:负责激活T细胞的效应功能
人体输注CAR-T细胞后,可通过scFv识别靶细胞表面的抗原,随后发生增殖,并通过释放穿孔素/颗粒酶或激活Fas/FasL通路来杀伤靶细胞。此外,持续存活的CAR-T细胞还能发挥长期免疫监测作用。CAR-T细胞治疗在自身免疫性疾病中初步显示出良好疗效,免疫介导性肾脏疾病的传统治疗模式正逐步向更精准的B细胞靶向治疗转变。
目前,毛建华等开展两项Ⅰ期临床试验(NCT06842589、NCT06553898)正在评估CD19-CAR-T细胞在多药耐药型SRNS患者中的安全性与有效性。尽管CAR-T在肿瘤领域已取得突破,但在自身免疫病中的应用仍面临细胞因子释放综合征(CRS)、神经毒性、成本高昂和长期安全性等挑战。
五、其他生物制剂
1. 泰它西普(Telitacicept)
泰它西普是一种重组TACI-Fc融合蛋白,可同时阻断BAFF和APRIL信号通路,抑制B细胞成熟和浆细胞分化。其在系统性红斑狼疮(SLE)和IgA肾病(IgAN)的临床试验中显示出良好的疗效和安全性,目前正在开展针对儿童FRNS/SDNS的临床试验(NCT06125405)。
2. 双特异性T细胞衔接器(BiTEs)
双特异性T细胞衔接器(BiTEs)是一种具有潜力的免疫治疗方法,通过利用T细胞介导的细胞毒性来靶向致病性B细胞。这类工程化分子包含两个单链可变片段(scFv):一个scFv结合T细胞表面的CD3以诱导T细胞活化,另一个scFv靶向B细胞表面抗原(如CD19、BCMA),从而引导T细胞清除自身反应性B细胞。目前评估blinatumomab(靶向CD19)在CNI耐药SRNS患儿中的疗效和安全性的临床试验正在进行中(NCT06607991)。
然而,BiTEs的应用仍需解决诸多挑战,如细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)、T细胞耗竭,以及因长期B细胞缺乏导致的感染风险,这些均需谨慎优化。
尽管仍需进一步临床验证,但BiTEs作为难治性NS的精准治疗手段具有重要潜力,为通过激活T细胞阻断B细胞驱动的自身免疫反应提供了新范式。
六、挑战与展望
尽管B细胞靶向治疗为NS患者带来新希望,但其临床应用中仍面临多重挑战:
疗效不一:不同病理类型(如MCDvs. FSGS)对治疗反应差异大;
安全性问题:包括感染、低球蛋白血症、免疫原性、CRS等;
个体化治疗面临两大核心挑战:缺乏可靠标志物,以及疾病异质性显著;
临床试验局限:多数研究为单中心、小样本、非随机设计,缺乏长期随访数据;
成本与可及性:CAR-T、双特异性抗体等新型疗法价格昂贵,限制其普及。
未来研究方向应包括:
利用单细胞测序、蛋白质组学等多组学技术寻找预测性生物标志物;
开展多中心随机对照试验,优化联合与序贯治疗策略,并开发免疫调节新方法(如调节性T细胞扩增);
开发成本更低、给药更便捷的制剂(如皮下注射);
加强国际合作,推动精准医疗在NS管理中的实现。
总结
抗B细胞策略已成为NS治疗的重要组成部分,尤其在传统治疗无效的难治性病例中显示出显著潜力。从利妥昔单抗到新一代抗CD20单抗、CD38靶向药物、CAR-T细胞疗法及双特异性抗体,治疗手段不断丰富。然而,尽管抗B细胞策略已革新了肾病综合征的治疗模式,但其广泛应用仍面临疗效差异大、安全性隐患、缺乏个体化治疗方案及可及性有限等多重挑战。未来研究应重点关注以下方向:阐明疾病潜在机制、筛选预测性生物标志物、优化临床试验设计、降低治疗成本,以推动疗法从实验室成功转化至临床应用。并通过多学科协作,推动这些创新疗法从实验室向临床转化,最终为NS患者提供更有效、更安全的治疗选择。
- 推荐文章
