- 首页 > 正文
祝之明教授解读原醛症——心肾代谢综合征的重要推手
发表时间:2026-02-02 15:50:23
编者按
随着肥胖、高血压、糖尿病等慢性病广泛流行,多系统共病管理日益成为焦点。“心血管-肾脏-代谢综合征(CKM)”概念的提出更强调了多系统疾病管理的整体性。在此背景下,原发性醛固酮增多症(PA,简称“原醛症”)作为继发性高血压最常见病因,其在CKM中的关键作用日益凸显,但临床筛查率和诊疗率仍严重不足。
在中华医学会第二十二次内分泌学学术会议(CSE 2025)上,陆军军医大学全军高血压与代谢病中心、重庆市高血压研究所、大坪医院祝之明教授以“原醛症:心肾代谢综合征的重要推手”为题展开精彩报告,系统阐述了PA与CKM的密切联系,揭示了以瞬时受体电位通道3(TRPC3)为核心的新型分子机制,并提出了“ARB/SGLT2i/他汀”创新三联治疗策略。本刊特整理报告精粹,以飨读者。

1、CKM:一个亟待重视的系统性疾病
CKM是一类心血管代谢共病,涵盖代谢危险因素、慢性肾脏病和心血管病,这些因素相互作用,导致多器官功能障碍和心脑血管事件,其发病与诸多因素有关。学界逐渐认识到,CKM是一种以肥胖为基础的心血管代谢共病,这一认知凸显了体重管理在CKM防控中的基石地位。
2、PA:被低估的CKM“幕后推手”
PA是因肾上腺皮质自主分泌过多醛固酮所致的临床综合征。尽管发现至今已近70年,其临床重要性仍被严重低估。数据显示,PA在高血压患者中患病率高达10%~20%,患病总数或超3000万(远超心肌梗塞患者数1200万);然而,高血压人群中PA的筛查率却不足1%[1]。大量患者被误诊为原发性高血压,进而错失精准治疗的机会。
心血管代谢共病是PA的重要特征(图1)。研究表明,与血压水平相当的原发性高血压(EH)患者相比,PA患者发生房颤、冠心病、心衰、非致死性心梗和卒中的风险,以及合并代谢综合征和糖代谢异常的风险均更高[2]。
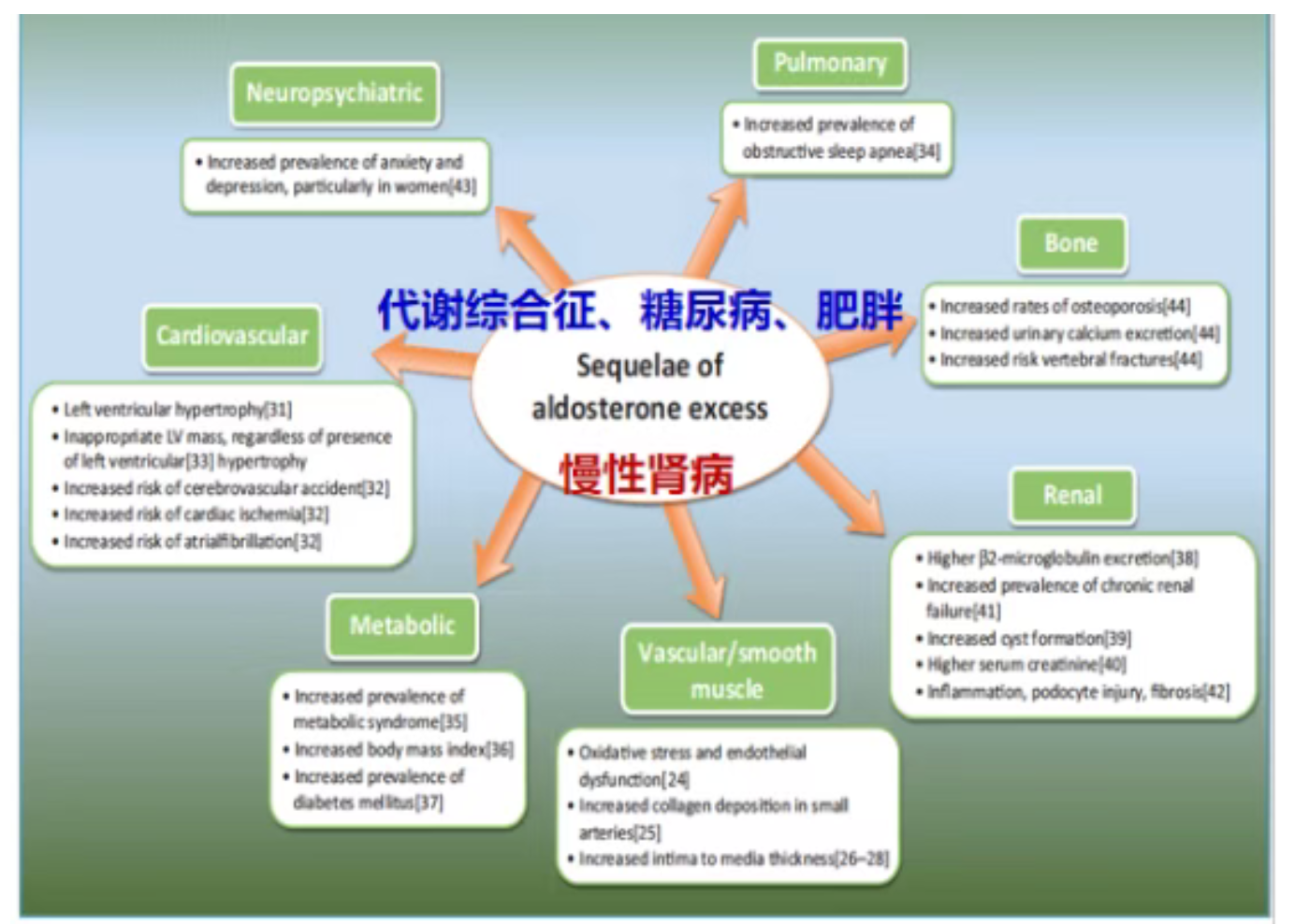
图1. 心血管代谢共病是原醛症的重要特征
3、PA:慢性肾脏病(CKD)的强力促进剂
肾脏是醛固酮过度分泌的另一主要受害器官。研究表明,PA患者的肾损伤程度远重于普通高血压患者:其蛋白尿发生率超50%,估算肾小球滤过率(eGFR)每年下降速率比高血压患者快3~5 ml/min,最终进展至终末期肾病(ESRD)的风险显著增加4.5~6.8倍[3]。这些证据清晰表明,PA通过加剧心、肾、代谢损伤,成为驱动CKM进展的关键因素。
4、肥胖与高醛固酮:触发CKM的始动因素
病理性高醛固酮血症通过与盐皮质激素受体(MR)结合,在心、肾、脂肪等组织中诱导氧化应激、炎症和纤维化。值得注意的是,肥胖与高醛固酮之间存在密切的相互促进关系:肥胖(尤其内脏脂肪堆积)可刺激醛固酮分泌,导致血压升高;反之,醛固酮作用于脂肪细胞,进一步诱导炎症反应和胰岛素抵抗,形成恶性循环。正是这种相互作用,使得原醛症患者更易合并肥胖与CKM。
二、机制探索:高醛固酮血症导致心肾代谢共病与TRPC3有关
高醛固酮可引发心血管代谢共病,但其具体机制似乎无法通过体细胞离子通道基因突变完全解释[4]。那么,其发病机制究竟如何?近二十年来,瞬时受体电位通道与高血压的关系受到关注[5]。
祝之明教授团队自2003年起开展系列研究,首次发现高血压患者与模型动物的多种细胞中,TRPC3表达水平升高,进而导致细胞内钙离子浓度增加;血管中的TRPC3表达可被血管紧张素II(AngII)与高盐环境上调,而血管紧张素II受体阻断剂(ARB)、钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i)可改善其功能,钙离子通道阻滞剂(CCB)则无此效应。
基于上述发现,团队构建了肾上腺皮质特异性过表达TRPC3的转基因小鼠。该模型成功模拟出PA的典型特征——高血压、高醛固酮、低血钾及肾素受抑制;进一步研究发现,TRPC3过表达会导致肾上腺皮质细胞内钙离子持续升高,上调醛固酮合酶(CYP11B2)的表达,最终促进醛固酮的大量分泌。而敲除内皮TRPC3能够减轻体重、增加血管舒张功能,并促进棕色脂肪血管增生及能量消耗。这些结果表明,TRPC3是连接心、肾、代谢三大系统的共同病理节点,有望成为干预CKM的全新药物靶点。
三、临床启示:拮抗肥胖与醛固酮改善CKM
1、现有治疗措施及困境
心血管代谢共病的防控始终以改善心脑血管异常、防治慢性肾脏损害、控制糖脂代谢紊乱为目标,以改善生活方式、药物治疗、介入治疗、手术治疗等为抓手,进行个体化的综合管理(图2)。
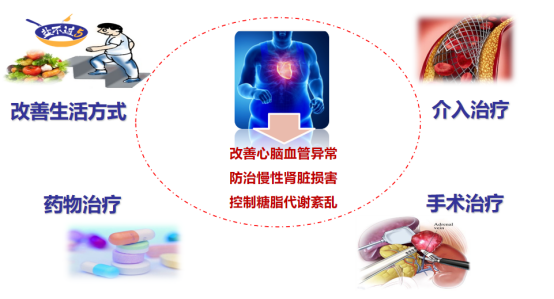
图2. 心血管代谢共病的防控措施
PA的特异性治疗方案包括盐皮质激素受体拮抗剂(MRA,如螺内酯、依普利酮);对于难治性CKM,可采用胃肠手术和肾上腺消融治疗;非特异性治疗则包括各类抗高血压药物。然而,即便患者血压、血钾得到控制,MRA治疗也无法完全消除PA患者的远期心血管风险,这提示单纯阻断盐皮质激素受体(MR)可能不足以逆转高醛固酮引发的系统性损害,临床需探索更全面的干预策略。
2、“ARB+SGLT2i+他汀”:一种创新的三联治疗策略
面临上述治疗困境,祝之明教授团队基于发病机制研究成果,创新性提出“ARB+SGLT2i+他汀”三联疗法(图3)。
其中,ARB可阻断肾素-血管紧张素-醛固酮系统(RAAS)、抑制血管TRPC3表达,从上游干预细胞钙超载;此外,研究还发现ARB——替米沙坦能够激活过氧化物酶体增殖物激活受体δ(PPARδ),减少脂肪堆积并提升肌肉胰岛素敏感性。SGLT2i已被证实具有明确的心肾保护和减重作用,同时可通过抑制血管TRPC3降低血压。他汀类药物(Statin)则能减少肾上腺对低密度脂蛋白胆固醇(LDL-C)的摄取,进而降低血醛固酮水平。
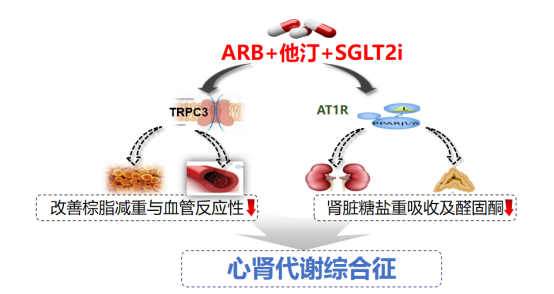
图3. ARB/SGLT2i/他汀三联方案及主要作用机制
由此可见,“ARB+SGLT2i+他汀”三联疗法,可分别从阻断RAAS系统、抑制TRPC3通道、改善代谢、减轻体重、减少醛固酮合成原料等多个关键环节发力,有望为CKM患者提供“标本兼治”的全新治疗选择。
总结
CKM是当前慢病管理的核心挑战,PA则是其重要且可干预的驱动因素。其中,肥胖与高醛固酮是推动CKM发生发展的核心病理因素,TRPC3在这一过程中发挥重要作用。因此,CKM的防治重点应放在及早控制高醛固酮血症与肥胖上。祝之明教授提出的“ARB+SGLT2i+他汀”三联疗法是基于病理生理机制的创新治疗组合,有望为CKM患者提供更全面的心肾代谢保护。
参考文献
1.Rossi GP, et al. Hypertension. 2024;81(9):1845-1856.
2.Linardi A, et al. Arch Endocrinol Metab. 2017;61(4):391-397.
3.Monticone S, et al. J Hypertens. 2020;38(1):3-12.
4..Azizan EAB, et al. Nat Rev Nephrol. 2023;19(12):788-806.
5.Dietrich A, et al. Mol Cell Biol. 2005;25(16):6980-6989.
- 推荐文章
