- 首页 > 正文
CCSN 2025丨张凌教授:CRRT血管通路关键因素分析及新型透析导管研发
发表时间:2026-02-02 16:53:01
编者按
连续性肾脏替代治疗(CRRT)是重症急性肾损伤(AKI)患者最常用的人工肾脏支持手段,其疗效与血管通路质量直接相关。然而,临床实践中体外循环凝血、导管功能障碍等问题频发,反复体外循环衰竭不仅延误了宝贵的治疗时间,也增加了并发症与医疗成本。在中华医学会肾脏病学分会第二十八届学术年会(CCSN 2025)上,四川大学华西医院华西肾脏病研究所张凌教授从影响体外循环寿命的关键因素分析到血管通路的优化选择,再到新型透析导管的研发,进行了精彩的报告,旨在推动CRRT治疗质量的提升。

专家简介

博士、主任医师、博士生导师
四川大学华西医院肾脏内科副主任、CRRT亚专业组长
中华医学会肾脏病分会委员
中国重症血液净化协作组副主任委员
四川省学术技术带头人/卫生健康领军人才
墨尔本大学Austin医学中心访问学者
发表论文150余篇,SCI论文80余篇
主持并参与多项科技部、国家自然科学基金、省支撑计划课题
获得专利20项,转化5项
作为副主编撰写《连续性肾脏替代治疗》专著
获得四川省科技进步一等奖/华夏医学科技进步二等奖
一、CRRT治疗现状与体外循环寿命的关键影响因素
据统计,在接受肾脏替代治疗的危重AKI患者中,选择CRRT的比例高达80.0%,远超过间断血液透析、腹膜透析(PD)及长时低效透析(SLED)[1]。然而,CRRT治疗面临着体外循环寿命短的难题。循环管路凝血是CRRT治疗停止的主要原因,其中滤器及静脉壶凝血最为常见,发生率超过70%[2]。反复体外循环衰竭会导致有效治疗时间缩短、血红蛋白和血小板大量丢失、出血风险大幅度增加、治疗费用增加、患者护理时间相对缩短[3,4]。
传统观念把循环管路凝血简单归咎于“抗凝不足”。然而,即便采用足量肝素或局部枸橼酸抗凝治疗,滤器寿命仍在5~157 h之间大幅波动[5]。通过多因素分析,研究者识别出多个与体外循环寿命相关的独立危险因素。其中,pH值、游离钙的影响最为显著[6]。
血流速度曾被认为是影响体外循环寿命的重要因素。一项随机对照试验对比了150 ml/min与250 ml/min两种血流速度对体外循环寿命的影响,结果显示两组并无明显差异。该研究还发现,采用无抗凝剂/肝素为主的体外循环寿命仅为10 h[7]。
人工肾脏的 “缺血” 问题也与体外循环衰竭密切相关。通过超声实时监测双腔导管入口流速发现其实际血流量常低于设定值(0.6次/h),与人工肾脏衰竭(AKF)有显著关联[8]。
二、CRRT血管通路的选择与优化
(一)CRRT血管通路的类型与适用场景
CRRT血管通路主要分为临时双腔导管、长期留置导管、动静脉内瘘及临时穿刺四类,不同通路的适用场景与血液净化方式存在明显差异。临时双腔导管因操作便捷、适用范围广,成为CRRT治疗的首选血管通路类型(表1)。
表1. CRRT血管通路种类与血液净化方式
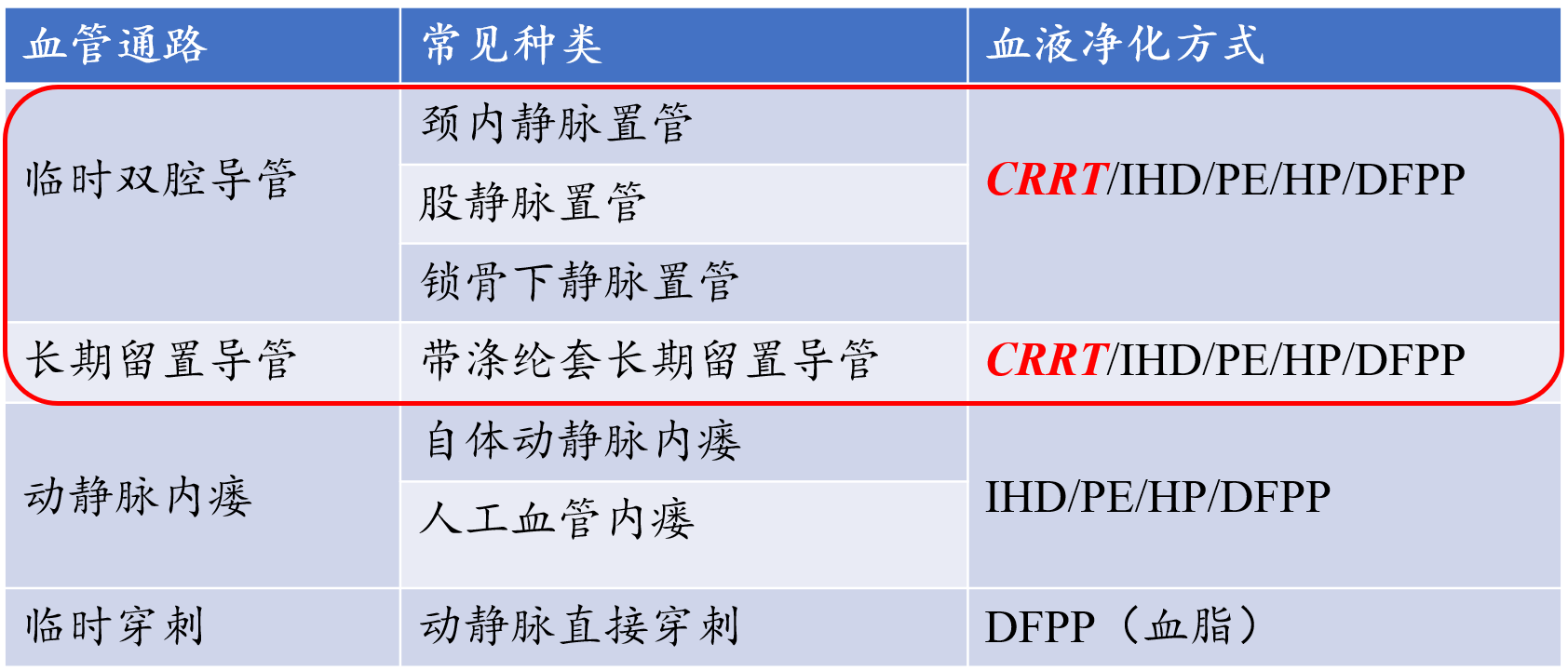
(二)临时双腔导管的选择与置管规范
1、置管部位的选择
不同置管部位的临床特点差异显著,直接影响治疗效果与并发症发生率。部分研究认为临时双腔导管中,股静脉置管体外循环寿命最长,颈内静脉次之,锁骨下静脉最短;但也有研究表明三种部位置管的体外循环寿命无显著差异[9]。JAMA上发表的一项随机对照试验显示,股静脉与颈内静脉置管的导管功能障碍发生率分别为9.7%和10.4%,无统计学差异[10]。KDIGO 2012 AKI指南建议以下优先顺序:第一选择为右侧颈内静脉,第二选择为股静脉,第三选择为左侧颈内静脉,最后选择为优势肢体侧的锁骨下静脉。
2、导管长度的优化
导管长度是影响CRRT体外循环寿命的关键因素之一,较长颈内静脉置管(20~24 cm)比短管(15~20 cm)的体外循环寿命更长,还能显著降低滤器凝血与通路功能障碍发生率[11]。临时双腔导管推荐长度为:股静脉(左右侧均20~25 cm)、颈内静脉(右侧12~15 cm、左侧15~20 cm)、锁骨下静脉(右侧12~15 cm、左侧15~20 cm)。
3、导管开口方式的影响
导管远端的开口方式主要包括单腔、双腔(分裂型、猎枪型)等。早期研究认为开口方式可能影响血流动力学与血栓发生率,但最新meta分析显示,分裂型、猎枪型与对称型导管在血流量、血栓事件及血流感染发生率上无显著差异[12]。另有研究指出,猎枪型与分裂型导管寿命一致,但血栓风险更低、更换频率更少;不过猎枪型导管增加侧孔可能提升血栓与感染风险[13,14]。
此外,为提高置管成功率、减少并发症,临床提倡在彩超引导下进行穿刺置管。置管过程中必须严格遵守无菌操作原则,以降低感染的风险。
(三)体外循环压力监测的重要性
体外循环压力监测是评估循环功能、早期识别导管功能障碍的重要手段。常用的压力监测指标包括循环入口压力(RIP)、循环出口压力(AOP)、滤出液压力(EP)、滤器前压力(PFP)及跨膜压(TMP)等(图1)。
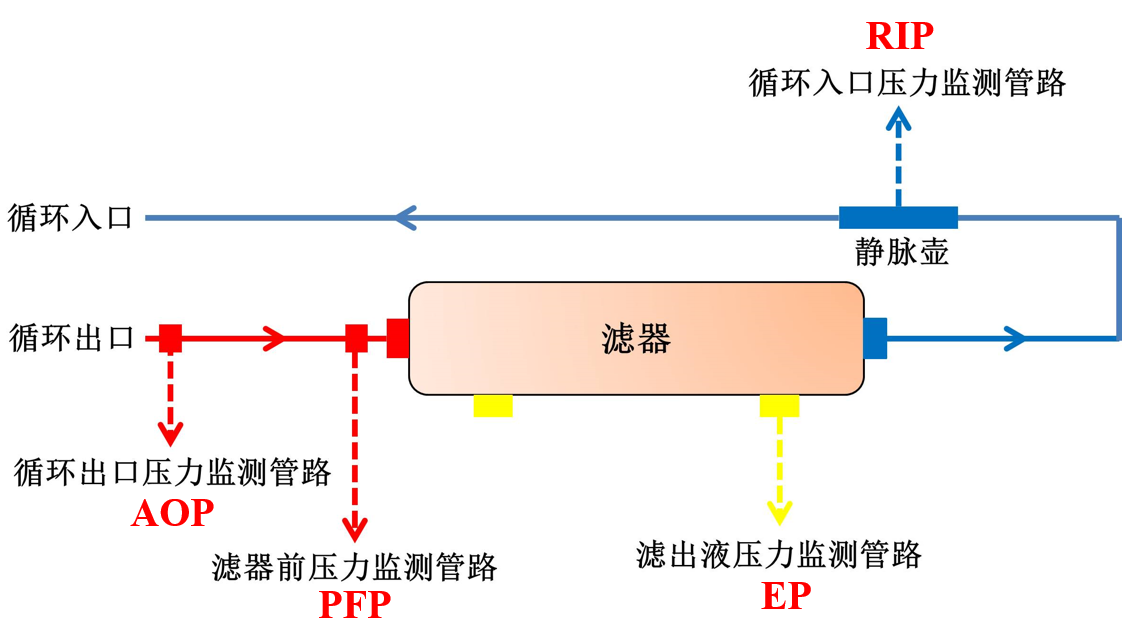
图1. 循环压力监测系统
发表在JAMA上的研究显示,仅10%的患者发生过导管功能障碍,然而,张凌教授团队的研究却发现约50%的循环管路发生过至少一次动静脉阻塞功能障碍(AOD)事件,说明大部分AOD事件是“安静”的,是人工肾脏的“隐形杀手[10]。Cox回归分析进一步证实,双腔导管动脉端功能不良、血小板水平是影响体外循环寿命的独立危险因素[15]。
三、CRRT透析导管的创新研发
为解决传统透析导管存在的血栓发生率高、感染风险大、血流动力学不稳定等问题,张凌教授团队联合多学科,开展了抗菌抗凝旋动流血液透析导管的研发工作,从结构改进与材料创新两方面实现突破。
人体主动脉弓处的血流呈旋动流状态,这种血流模式能有效冲刷沉积在血管壁的有害物质,降低血栓风险。研发团队借鉴这一生理特点,基于导管模型建立及血流动力学探索结果,在导管内部加入旋动流设计,使管腔内血流形成稳定的旋动流场[16,17](图2)。
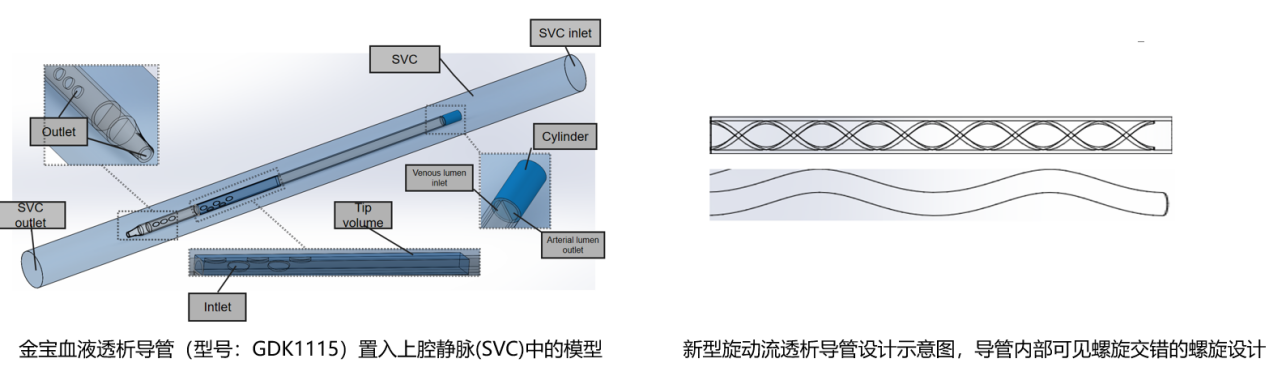
图2. 金宝血液透析导管(型号:GDK1115)置入上腔静脉(SVC)中的模型(左);新型旋动流透析导管设计示意图,导管内部可见螺旋交错的螺旋设计(右)
为进一步降低血栓与感染风险,研发团队研发了多种抗菌抗凝复合涂层。其中,铜铵-肝素涂层对1×106 CFU/mL的大肠杆菌、金黄色葡萄球菌杀菌率均达99.9%。家猪透析模型显示,铜铵-肝素涂层导管血栓形成量减少89.2%(图3)。另一种氟化石墨烯涂层(FG涂层)是一种超疏水涂层,能有效阻止血细胞及凝血因子等成分接触导管材料表面,从源头上减少血栓形成。

图3. 负载铜铵-肝素涂层
四、小结
CRRT血管通路是决定CRRT治疗成败的关键环节,其优化与创新是提升CRRT治疗质量的核心方向。通过对CRRT血管通路的系统研究,我们明确了影响体外循环寿命的关键因素,确定了导管的优选类型、置管部位与规范,并创新性研发了抗菌抗凝旋动流血液透析导管。未来,随着新型透析导管的临床转化与应用,以及体外循环监测技术的不断升级,CRRT血管通路的稳定性将进一步提升,患者的治疗安全性与有效性也将得到更好保障。
参考文献
[1] Acute Renal Failure in Critically Ill Patients. JAMA 2005; 294: 813-818.
[2] Critical Care 2007,11:218[3] AJKD. 1997;30:S20-27.[4] Contributions to nephrology. 2007;156:178-184.[5] Am J Kidney Dis. 2012;59(6):810-818[6] ASAlO Joumal 2012[7] A Randomized Controlled Trial. Crit Care Med. 2017 Oct;45(10):e1018-e1025.
[8] Intensive Care Med (2004)30:2074-2079
[9] Critical Care and Resuscitation ,Volume 16 Number 2 o June 2014
[10] JAMA.2008;299(20):2413-2422
[11] Am J Kidney Dis. 2012;60(2):272-279
[12] J Vasc Surg. 2019 Apr;69(4):1282-1292.
[13] Eur J Vasc Endovasc Surg. 2017 Feb;53(2):262-267.
[14] PLoS One. 2020 Aug 7;15(8):e0236946.
[15] Blood Purif 2016;41:254-263
[16] J Funct Biomater. 2022 Nov 11;13(4):236.
[17] Front Bioeng Biotechnol. 2025 Mar 13:13:1545996.
- 推荐文章
