- 首页 > 正文
如何对肥胖合并CKD患者进行个体化肾脏保护治疗?来自ERA Diabesity工作组的述评
发表时间:2026-02-03 09:43:15
引言
肥胖与2型糖尿病(T2DM)的全球流行导致慢性肾病(CKD)患病率上升,进而增加心血管事件风险并可能进展至终末期肾病(ESKD)。过去十年间,这类患者的治疗选择迅速扩展。ERA糖胖病(Diabesity)工作组对这一领域的进展进行了全面述评,重点关注了胰高血糖素样肽-1受体激动剂(GLP-1RAs)在超重/肥胖和T2DM合并CKD患者管理中的作用,总结了KDIGO CKD指南的最新推荐,并探讨了其他基于肠道激素的疗法(如GLP-1/葡萄糖依赖性促胰岛素多肽双重激动剂、三受体激动剂和胰淀素类似物)以及非甾体盐皮质激素受体拮抗剂(nsMRAs)的潜力。同时,工作组还强调了多靶点治疗策略(包括RAAS抑制剂、SGLT2抑制剂、肠促胰素类药物和nsMRAs)对改善心血管和肾脏结局的潜在价值。
肥胖伴或不伴T2DM与CKD的结合是全球性医学问题,肾科医生需在制定个体化治疗策略中发挥主导作用。2020年全球成人超重(BMI≥25~30 kg/m²)和肥胖(BMI≥30 kg/m²)患病率达42%,预计2035年将升至54%。CKD患者中超重和肥胖比例更高,例如2018-2019年西欧某三级肾病中心报告显示这一比例超过70%。肥胖相关并发症随CKD阶段不同而异,包括CKD进展、肾移植困难、心血管风险增加、住院率上升、医疗成本增加以及生活质量和预期寿命下降。
《柳叶刀·糖尿病与内分泌学》委员会近期重新定义了肥胖,区分了临床前肥胖(无器官功能障碍)和临床肥胖(伴器官功能障碍)。美国心脏协会(AHA)提出心血管-肾脏-代谢(CKM)综合征概念,强调需多学科综合管理以降低发病率和死亡率。近年来,RAAS抑制剂(RAASIs)、SGLT2抑制剂(SGLT2is)、GLP-1RAs和nsMRAs已成为这类患者治疗的基石。
一、GLP-1RAs在特定肾脏疾病人群中的作用
1.超重/肥胖或T2DM合并CKD
GLP-1RAs的肾脏保护作用最初在T2DM和高心血管风险患者的CVOTs中被发现。这些研究显示GLP-1RAs可减少新发大量白蛋白尿,从而促使研究者们设计了首个以肾脏结局为主要终点的FLOW试验(司美格鲁肽 1 mg/周)。SELECT试验(司美格鲁肽2.4 mg/周)和SMART试验也显示司美格鲁肽在非糖尿病CKD患者中降低白蛋白尿的效果。
FLOW试验纳入高CKD进展风险的T2DM患者(eGFR 25~75 ml/min/BSA,UACR 100~5000 mg/g),结果显示司美格鲁肽组主要肾脏结局(eGFR下降≥50%、ESKD或肾脏/心血管死亡)风险降低24%,年eGFR下降速度较安慰剂组减缓>1 ml/min/BSA。然而,GLP-1RAs在1型糖尿病、非白蛋白尿性DKD、非糖尿病CKD及正常体重CKD中的效果仍需进一步研究。
2.终末期肾病(ESKD)
ESKD患者大多被排除在GLP-1RAs的CVOTs之外,GLP-1RAs对晚期CKD及ESKD患者心血管与肾脏结局的影响尚不明确,应成为未来研究的重点方向。小型RCT和回顾性研究(主要使用利拉鲁肽)显示,GLP-1RAs可改善ESKD患者的血糖控制和体重,但胃肠道副作用可能更常见。GLP-1RAs可能通过减重帮助ESKD患者达到肾移植的BMI要求。
3.肾移植受者
目前缺乏GLP-1RAs在肾移植受者中的RCT数据。观察性研究显示GLP-1RAs可导致体重减轻(2~5kg)和HbA1c下降,但对eGFR影响不一致。一项观察性研究提示GLP-1RAs可能降低MACE和全因死亡率,但需RCTs验证。
二、KDIGO指南中的GLP-1RAs
2022年《KDIGO慢性肾脏病患者糖尿病管理临床实践指南》将GLP-1RAs作为二线选择,推荐用于高心血管风险、残留白蛋白尿或需强化血糖控制/减重的T2DM合并CKD患者。2024年CKD指南发布时FLOW试验结果尚未公布,因此对GLP-1RAs的推荐较之前的版本无明显更新。未来指南可能会将GLP-1RAs与RAASIs、SGLT2is和nsMRAs并列为CKD治疗时心血管和肾脏保护的四大支柱药物,占据核心地位。
三、GLP-1RAs的作用机制
GLP-1RAs通过改善体重、血压、血糖和血脂等中间因素发挥心血管和肾脏保护作用。GLP-1RAs还能降低白蛋白尿(在GLP-1RA相关CVOTs及FLOW试验中均有观察),从而减少肾小管损伤,延缓CKD进展。
GLP-1RAs的肾脏保护作用还涉及其他机制(图1)。在代谢/肥胖手术后,内源性GLP-1信号通路激活是实现肾脏保护的核心机制。GLP-1RAs似乎能直接对抗肥胖和T2DM相关CKD的多种病理生理机制。
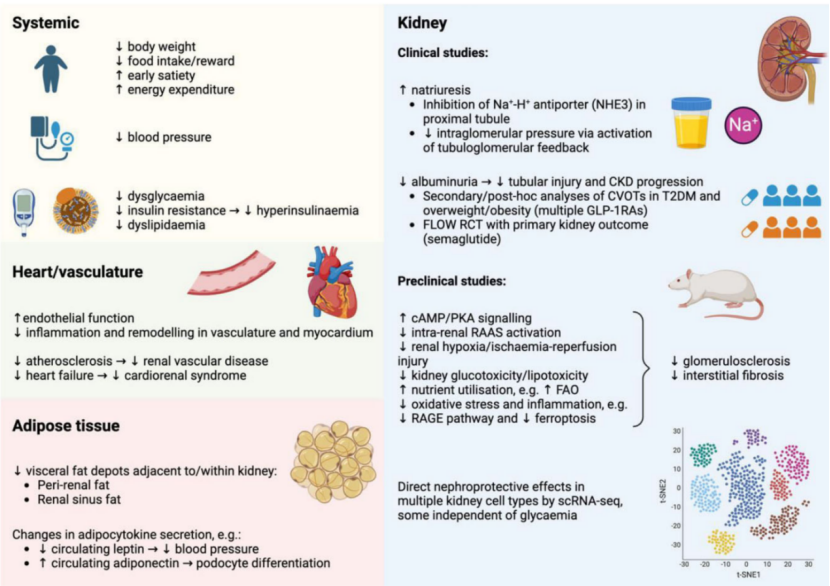
图1. GLP-1RAs的潜在肾脏保护作用机制(引自发表的原文)
对于肥胖患者,使用GLP-1RAs减重后,可减少肾周和肾窦脂肪("脂肪肾"),缓解机械压迫和脂毒性,从而改善血压并减轻肾脏损伤。
GLP-1RAs可抑制近端小管Na+/H+逆向转运蛋白(NHE3),促进尿钠排泄,通过管球反馈降低肾小球内压,从而改善肾小球血流动力学。
GLP-1RAs可激活cAMP/PKA信号通路,减少肾内RAAS激活。
单细胞转录组分析显示,GLP-1RAs对多种肾脏细胞类型(包括肾小球内皮细胞、足细胞、近端小管细胞和巨噬细胞)具有独立于血糖的保护作用。
GLP-1RAs可能对近端小管的生物能量代谢具有有益影响。表现在:应用GLP-1RAs后,近端小管细胞和内皮细胞向保护性脂肪酸氧化方向转变,后者提示GLP-1RAs可能通过改善肾脏营养利用和线粒体功能,延缓DKD进展。类似地,在DKD动物模型中,过氧化物酶体增殖物激活受体α介导的近端小管脂肪酸氧化,被证实是“有意减重+多模式药物治疗(含GLP-1RAs)”发挥肾脏保护作用的关键机制。
四、其他肠道激素衍生疗法
1.替尔泊肽(双重GLP-1/GIP受体激动剂)
目前尚无针对替尔泊肽用于CKD患者的关键研究。SURPASS-4试验事后分析显示,替尔泊肽较甘精胰岛素显著降低UACR(治疗85周后差异达37%),延缓eGFR下降速度(-1.4 vs. -3.6 ml/min/BSA/年),减少复合肾脏结局风险。
2.胰高血糖素和胰淀素
双重GLP-1R/GCGR激动剂(如cotadutide、mazdutide、survodutide)和GLP-1R/GIPR/GCGR三受体激动剂(如retatrutide)在减重方面显示出前景。
胰淀素由胰腺β细胞与胰岛素同步分泌,可提高机体对瘦素的敏感性,并直接在大脑中发挥作用,促进餐后饱腹感的产生。第二代胰淀素类似物cagrilintide与司美格鲁肽联用在Ⅱ期试验中减重效果显著(减重15.6%),但对肾脏结局的影响尚待研究。其他在研的胰淀素类似物还包括petrelintide、Amycretin。
五、未来展望
1.GLP-1RAs与肾脏疾病相关的未解问题
GLP-1RAs在CKM谱系中的作用日益重要,但仍存在许多知识空白:
对于已使用RAAS抑制剂和SGLT2抑制剂的患者,GLP-1RAs是否提供额外的肾脏保护?
GLP-1RAs的最佳治疗持续时间?
是否存在GLP-1RAs无效的BMI阈值?
GLP-1RAs在肾移植中的作用?
GLP-1RAs在非糖尿病肾病中的肾脏保护效果?
GLP-1RAs的其他多效性作用?
透析患者CKM综合征负担重,但GLP-1RAs在这类人群中的安全性和有效性数据有限。观察性研究提示GLP-1RAs可能与较低的全因死亡率相关,需进一步研究验证。
2.RAASi与MRA作为抗肥胖药物的潜力
RAASi和nsMRA目前尚未被认可为抗肥胖药物,也未被归类为此类药物。但这两类药物可能通过影响与肥胖相关的通路(如调节脂肪组织功能、炎症反应和代谢异常),间接发挥改善肥胖的作用。
RAASi参与抗肥胖的机制可能包括:抑制血管紧张素Ⅱ和醛固酮的作用,可能减少脂肪生成和脂肪堆积;可改善胰岛素敏感性和葡萄糖摄取,间接促进体重下降和脂肪减少;通过调节下丘脑调节食欲和饱腹感的中枢通路,潜在影响食物摄入。
nsMRA(如非奈利酮)可影响炎症信号通路,并通过拮抗盐皮质激素受体调节脂肪组织功能,并可能通过改善代谢间接为体重管理提供支持。
3.多靶点肾脏保护治疗(RAASi+SGLT2i+GLP-1RA+MRA)
四十余年的证据表明RAAS抑制剂可改善糖尿病和其他原因肾病的肾脏结局。近年来,SGLT2抑制剂和GLP-1RAs也显示出对心血管和肾脏结局的改善作用。FLOW试验中15.6%的患者基线时使用SGLT2抑制剂,事后分析显示联合治疗可能有叠加效益,但需前瞻性RCTs验证。司美格鲁肽及其他GLP-1RAs是治疗肥胖合并CKD患者的潜在有效药物。
nsMRA非奈利酮在T2DM合并CKD患者中显示出肾脏和心血管保护作用,且不受肥胖程度影响。指南推荐非奈利酮作为T2DM合并CKD患者的附加治疗。未来研究应关注非奈利酮与RAASi、SGLT2i和GLP-1RA的联合使用。
总结
我们正进入针对CKM综合征有害影响的新治疗时代。尽管存在局限性,但大量科学证据表明新药(SGLT2is、GLP-1RAs和nsMRAs)有望改善整体健康结局并减少健康不平等。未来可能会出现GLP-1-GIP-胰高血糖素三受体激动剂等更多组合疗法,带来更好的减重和心脏代谢健康效果。肾科医生的观点对于新试验的开展和这些新疗法在高心血管风险CKD患者中的应用具有关键意义。
来源:Nephrology Dialysis Transplantation, gfaf069,https://doi.org/10.1093/ndt/gfaf069
- 推荐文章
