- 首页 > 正文
NDT最新综述:狼疮肾炎的最佳糖皮质激素治疗策略——从“足量足疗程”到“低毒高效”的演进之路
发表时间:2026-02-03 11:04:48
一、糖皮质激素的作用机制
糖皮质激素通过基因组和非基因组两种途径发挥作用,同时也会因特定机制引发不良反应。
01、抗炎作用机制
基因组途径:活性GC与胞浆内GRα结合后进入细胞核,抑制NF-κB、AP-1等转录因子,下调IL-1、IL-6、TNF-α等促炎因子表达,同时上调IL-10、TGF-β等抗炎介质。。
非基因组途径:大剂量静脉甲强龙(MP)脉冲可在数分钟内通过膜受体及线粒体途径迅速阻断Ⅰ型干扰素信号,为急性肾损伤“灭火”。
代谢重编程:GC促进三羧酸循环代谢产物衣康酸(itaconate)生成,间接抑制炎症小体活化。
02、不良反应机制
长期应用抑制成骨细胞、激活破骨细胞,导致骨质疏松;诱导胰岛素抵抗与糖异生,引发类固醇糖尿病;抑制11β-HSD2,激活盐皮质激素受体,导致水钠潴留、高血压。
二、糖皮质激素治疗LN的历史演变
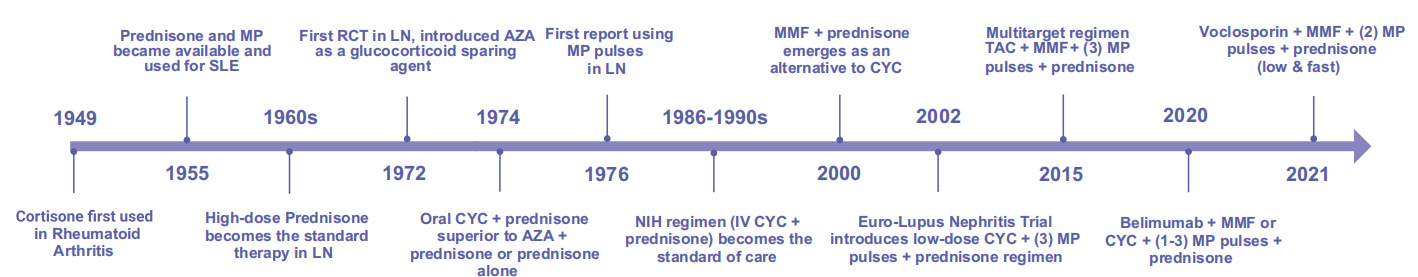
图1. 糖皮质激素及免疫抑制疗法在LN治疗中的演变。AZA:硫唑嘌呤;CYC:环磷酰胺;MP:甲基强的松龙;TAC:他克莫司。
1949年,Hench首次报道可的松治疗类风湿关节炎的惊艳效果,随后迅速推广至SLE。
1960年代Pollak证实高剂量泼尼松(47.5 mg/d)显著降低LN死亡率,奠定“足量足疗程”理念。但随之而来的感染、骨质疏松等副作用促使研究者探索“激素+免疫抑制剂”模式:
1972年,梅奥诊所开展了首个随机对照试验(RCT),对比硫唑嘌呤联合泼尼松与单用泼尼松(≤20mg/天)的疗效,未发现加用硫唑嘌呤有明显益处。1974年,美国国立卫生研究院(NIH)的一项里程碑式研究显示,口服环磷酰胺联合泼尼松(≤0.5mg/kg/天)的疗效优于硫唑嘌呤联合泼尼松或单用泼尼松,该方案在20世纪70年代成为标准治疗方案。
1976年,Cathcart首次采用MP 1 g/d×3天脉冲治疗快速进展型LN,奠定脉冲疗法雏形。
20世纪80~90年代,NIH团队进一步优化狼疮肾炎治疗方案,研究证实静脉注射环磷酰胺联合口服泼尼松(最高 0.5mg/kg/天)疗效显著。90年代的RCT研究对比了每月甲泼尼龙冲击联合口服泼尼松、每月静脉环磷酰胺联合口服泼尼松以及两种方案联合使用的效果,结果支持静脉环磷酰胺联合口服泼尼松的“NIH方案”,该方案在90年代成为标准治疗方案。
进入21世纪后,霉酚酸酯(MMF)、他克莫司(TAC)、生物制剂(贝利木单抗、伏环孢素)相继登场,推动“低剂量GC+多靶点免疫抑制”新时代。
2021年AURORA试验:伏环孢素+MMF+低剂量MP脉冲+快速递减泼尼松(16周内降至2.5 mg/d),证实高效且低毒。
三、循证剂量策略
01、诱导期方案
静脉MP脉冲:系统综述纳入37项RCT、3231例患者,起始给予0.5~0.75 g/d×3天脉冲,可提高完全缓解率≥5%,且不增加严重感染。
口服泼尼松起始剂量:
0.4~0.7 mg/kg/d(≤40 mg/d):完全缓解率约25%,感染/死亡风险低。
≥0.7 mg/kg/d:缓解率虽升至35%,但感染及死亡风险呈剂量依赖性增加。
推荐方案:综合现有证据,建议“0.5 g/d×3天MP脉冲+0.5 mg/kg/d泼尼松起量”,维持2~4周后进入递减阶段。
02、递减策略
第16周前减至5 mg/d,可减少感染风险;若联合MMF或CYC,过快减量(≤7.5 mg/d)可能降低6~12个月缓解率,需个体化权衡。
递减原则:>30 mg/d时可快减,每1~2周减5~10 mg;接近15 mg/d时减速,每2~4周减1`2.5 mg;<5 mg/d每月减1 mg,避免激素撤药综合征。
03、维持与停药
对已进入完全肾缓解且肾外表现稳定的患者,可尝试≤5 mg/d长期维持或停药。12个月RCT显示,停5 mg/d组复发风险显著升高;提示极低剂量维持可能更安全。停药过程宜采用“1 mg/月”微减方案并密切监测。
四、激素替代/减量探索
Lupus-Cruces方案:MP 0.25–0.5 g×3天+口服泼尼松≤30 mg/d快速递减+低剂量IV CYC,观察性研究提示缓解率良好且毒性低。
Rituxilup方案:利妥昔单抗两次+MP 0.5 g×2次,无口服激素,维持MMF 3 g/d,初步结果不劣于传统方案。
新型GC受体激动剂:fosdagrocorat(分离型激动剂)在RAⅡb期试验中显示疗效与泼尼松相当,但代谢副作用更小,未来有望在LN中验证。
五、停药相关问题及不良反应防治策略
01、停药相关问题
长期使用糖皮质激素可能抑制下丘脑-垂体-肾上腺轴,引发肾上腺功能不全,在风湿病患者中发生率可达40%。老年、肥胖患者,使用地塞米松、倍他米松等长效、高效糖皮质激素的患者,用药超过1个月的患者,以及每日多次给药或睡前给药的患者风险更高,而冲击治疗引发该问题的风险相对较低。但需注意糖皮质激素戒断综合征,这是由于患者对超生理浓度糖皮质激素产生依赖所致,症状包括关节痛、疲劳、低热,偶尔还会出现焦虑、抑郁等精神症状,在减量过程中都可能发生,当泼尼松剂量降至≤15mg/天时更为常见。
02、不良反应及风险防控(图2)
感染:为SLE首位死因。措施包括:①尽可能降低GC剂量;②全程使用羟氯喹;③接种肺炎球菌、带状疱疹、SARS-CoV-2、HBV等灭活疫苗;④高危患者考虑PCP预防。
骨质疏松:治疗前及6个月内行骨密度检测;补充钙1000–1200 mg/d+维生素D 600–800 IU/d;口服或静脉双膦酸盐(如唑来膦酸)用于泼尼松>30 mg/d或累积量≥5 g/年者。
糖代谢异常:≥7.5 mg/d即可诱发胰岛素抵抗。建议生活方式干预,必要时启用降糖药;羟氯喹可降低糖尿病风险40%。
心血管风险:GC累积量越高,心血管事件越多。目标血压<120/80 mmHg,首选ACEI/ARB;他汀类按普通人群指征启动;戒烟、地中海饮食、规律运动。
肾上腺抑制与撤药综合征:长期使用后HPA轴抑制率高达40%。使用短效制剂(泼尼松)、每日一次晨服、递减至生理剂量后减慢速度,可有效减少撤药反应。
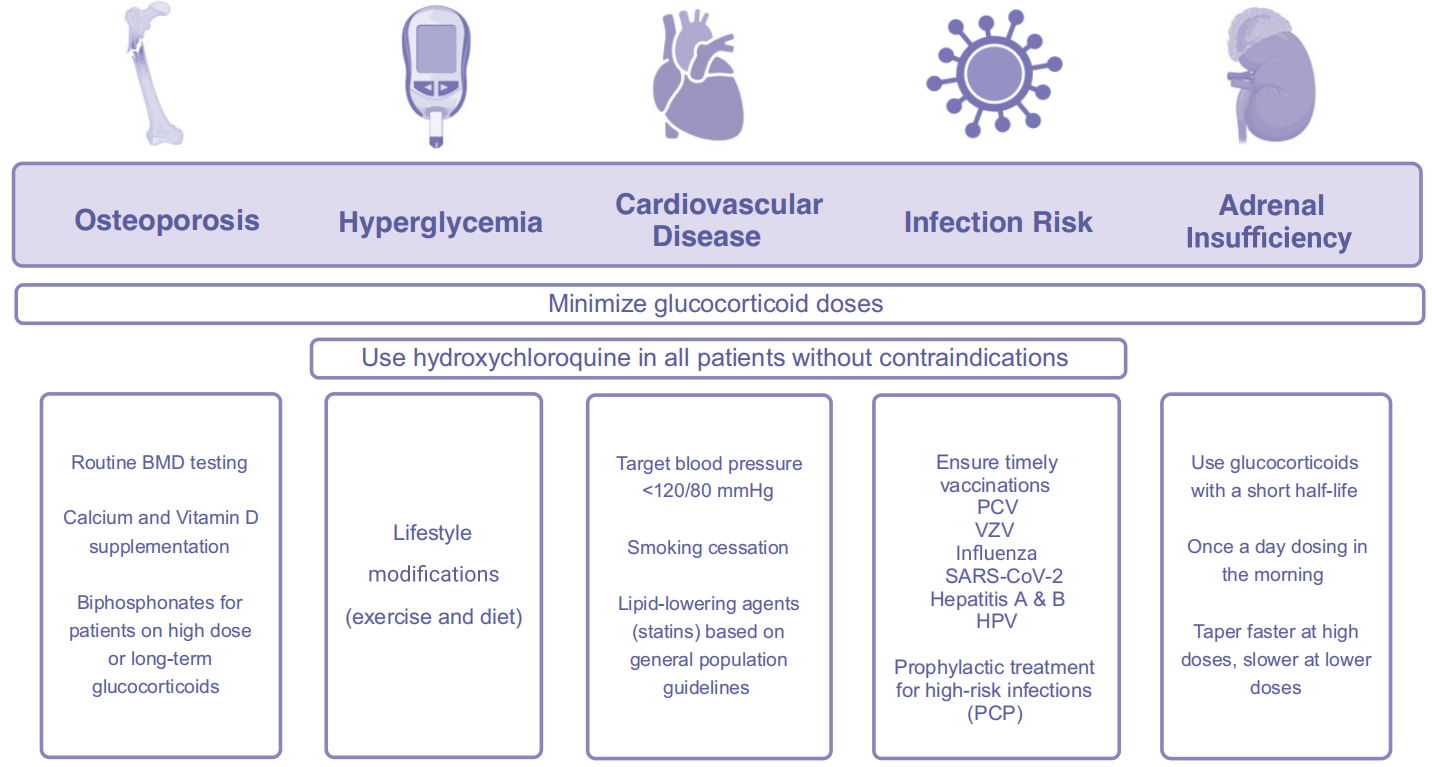
图2. 糖皮质激素治疗的副作用及防治策略
03、特殊人群考量
妊娠:妊娠期狼疮肾炎患者可能需要使用糖皮质激素,但高剂量使用会带来诸多问题。对母体而言,会增加子痫前期、早产、胎膜早破、静脉血栓栓塞的发生风险;对胎儿来说,可能导致低出生体重、早产风险升高,且有研究提示孕早期使用糖皮质激素可能略微增加胎儿口面部裂的风险,但不同研究结果不完全一致。
儿童:基于成人数据的共识推荐,增殖性LN起始剂量可达60 mg/d,可分次服用,但需警惕生长抑制及精神症状。密切监测身高、骨龄、眼科及心理行为。
六、结论与未来展望
75年来,LN的GC治疗经历了“高剂量—联合免疫抑制—低毒策略”的螺旋式上升。现代循证方案强调:
①诱导期“MP脉冲+中剂量泼尼松”;
②快速、可控的递减路径;
③全程不良反应主动监测与干预;
④积极探索无激素或超低激素方案。
未来需开展高质量RCT,比较不同GC剂量、脉冲次数及完全停药策略在不同病理分级LN中的疗效与安全性;同时推进新型选择性GC受体激动剂、生物制剂及精准免疫调节的临床转化,使LN治疗真正迈向“疗效最大、毒性最小”的精准医学时代。
参考文献:Figueroa-Parra G, et al. Nephrol Dial Transplant. 2025; 40: 1284-1293.
- 推荐文章
